8. БИОХИМИЧЕСКАЯ ОЧИСТКА
8. БИОХИМИЧЕСКАЯ ОЧИСТКА
8.1. Краткие сведения из теории
8.1.1. Область применения биохимической очистки
Биохимическая очистка позволяет разрушить различные органические соединения, причем в некоторых случаях достигается глубокий распад. В состав органических веществ входят углерод, водород, иногда кислород, азот, сера, фосфор, галогены.
Атомы углерода обладают уникальной способностью образовывать неограниченные по длине цепи, причем, между атомами возникают как одинарные, так и двойные и тройные связи (табл. 8.1). Наиболее прочны одинарные связи, хотя суммарная энергия двойных и тройных связей больше.
Таблица 8.1
Энергия химических связей органических веществ (ковалентные, углеродные и водородные) [21]
|
Связь |
Энергия,КДж/моль |
Связь |
Энергия,КДж/моль |
|
C–H |
414 |
O–H |
460 |
|
C–C |
339 |
N–H |
389 |
|
C=C |
611 |
N–N |
163 |
|
CºC |
833 |
C–CL |
327 |
|
C–O |
368 |
C–Br |
272 |
|
C=O |
724 |
C–J |
239 |
|
C–N |
306 |
O–O |
147 |
|
C=N |
594 |
–H–O (водородная) |
21 |
|
CºN |
887 |
–H–N (водородная) |
8 |
Деструкция органических молекул направлена на упрощение их структуры и отщепление (элиминирование) отдельных фрагментов. Разрушение молекул чаще всего проходит в местах наименее прочных связей. О возможной степени деструкции некоторых органических соединений при биохимической очистке можно судить по соотношению значений БПКполн и ХПК: чем ближе оно к единице, тем более глубокий распад следует ожидать (табл. 8.2).
Таблица 8.2
Значения БПКполн и БПКполн/ХПК некоторых органических соединений в расчете на 1 мг вещества
|
Соединение |
БПКполн |
БПКполн/ХПК |
|
Углеводороды |
||
|
Бензол С6Н4 |
1,15 |
0,37 |
|
Толуол С6Н5СН3 |
1,1 |
0,59 |
|
Хлороформ СН3Сl |
0 |
0 |
|
Нефть |
0,3–0,4 |
0,1 |
|
Бензин (крекинг) |
0,11 |
0,03 |
|
Спирты |
||
|
Метиловый СН3ОН |
0,98 |
0,65 |
|
Бутиловый С4Н9ОН |
1,43 |
0,55 |
|
Глицерин С3Н5(ОН)3 |
0,86 |
0,7 |
|
Эфиры |
||
|
Трибутилфосфат (С4Н9О)3РО4 |
0,1 |
0,05 |
|
Уксусноэтиловый эфир СН3СООСН2СН3 |
1,49 |
0,81 |
|
Альдегиды |
||
|
Формальдегид СН2О |
0,75 |
0,7 |
|
Масляный СН3СН2СН2СНО |
1,23 |
0,5 |
|
Кетоны |
||
|
Ацетон СН3СОСН3 |
1,68 |
0,77 |
|
Органические кислоты |
||
|
Уксусная СН3СООН |
0,86 |
0,81 |
|
Муравьиная НСООН |
0,28 |
0,79 |
|
Акриловая СН2СНСО2Н |
0,83 |
0,62 |
|
Амины |
||
|
Диэтиламин (С2Н5)2NН |
1,31 |
0,44 |
|
Анилин С6Н5NН2 |
1,9 |
0,79 |
|
Триэтиламин (С3Н5)3N |
0,05 |
0,02 |
|
Углеводы |
||
|
Глюкоза С6Н12О6 |
1,01 |
0,6 |
|
Фенолы |
||
|
Фенол С6Н5ОН |
1,17 |
0,49 |
|
Крезол СН3С6Н4ОН |
1,56 |
0,62 |
|
О–пирокатехин С6Н7(ОН)2 |
1,47 |
0,78 |
|
Гидрохинон С6Н4(ОН)2 |
0,46 |
0,24 |
|
Нитриды |
||
|
Азодимитрил изол масляной кислоты С8Н7N4 |
0,07 |
0,05 |
Как следует из таблицы, возможная эффективность биохимической очистки органических соединений колеблется в больших пределах:
от 70–80 % до нуля.
Многие примеси, присутствующие в бытовых сточных водах, разрушаются полностью. Биохимические методы применимы так же для окисления и восстановления комплексных соединений с последующим удалением тяжелых металлов переменной валентности: железа, марганца, хрома, ртути.
Биохимическая деструкция происходит в результате таких процессов, как окисление, восстановление, гидролиз, декарбоксилирование, дезаминирование и других.
Принципиальное отличие биохимических процессов деструкции от химических заключается в том, что первые осуществляются с участием катализаторов биохимического происхождения – ферментов.
8.1.2. Ферменты как катализаторы химических процессов
Ферменты или энзимы синтезируются живой клеткой в процессе ее жизнедеятельности. Механизм инициирования ферментами биохимических процессов связан с переносом энергии к молекулам загрязнений, которые после этого становятся реактивно–способными. Фосфатные соединения, например, АТФ (аденозинтрифосфатная кислота), входящие в состав ферментов, аккумулируют энергию. Энергия передается тем молекулам, которые способны присоединять фосфатные фрагменты молекул АТФ.
Взаимодействуя с молекулами субстрата (так будем называть водные загрязнения) ферменты понижают необходимую для реакции энергию активации (см. п. 6.1). Под их влиянием изменяется маршрут деструкции субстрата таким образом, что превращение проходит через ряд промежуточных этапов, требующих меньших затрат энергии, чем при маршруте химических реакций без катализатора.
Качество катализатора оценивается количеством контактов его молекул и молекул субстрата за единицу времени. Установлено, что для ферментов этот показатель на 5–7 порядков выше, чем у неорганических катализаторов. Ферменты обладают специфичностью, т.е. воздействием только на конкретные виды субстрата.
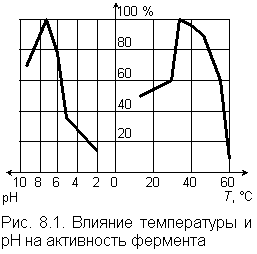 |
Немецкий ученый Э. Фишер сравнил субстрат с замком, а фермент с ключом, который подходит только к этому замку.Действие ферментов зависит от физико-химических характеристик воды. В частности, на состояние ферментов влияет содержание в воде микроэлементов из числа тех, которые входят в состав самого фермента. Например, ферменты, катализирующие окислительно-восстановительные реакции, чувствительны к присутствию в воде железа и меди, ферменты, ответственные за восстановление нитратов – к присутствию молибдена. Влияние на активность ферментов температуры и рН воды иллюстрируется графиками на рис. 8.1. Как следует из графиков, построенных по результатам эксперимента с ферментом липазой, даже незначительное отклонение температуры и рН от оптимальных значений приводит к резкому снижению активности. Такой вывод справедлив и для других ферментов. |
По характеру воздействия на субстрат ферменты делятся на шесть основных групп:
- оксидоредуктазы, осуществляющие отщепление водорода и перенос электронов, ответственные за окислительно‑восстановительные процессы;- трансферазы, осуществляющие перенос химических групп;- гидролазы, которые катализируют процесс гидролиза;- лиазы, катализирующие отщепление атомных групп;- изомеразы, вызывающие превращение органических веществ в их изомеры;- лигазы, образующие новые связи и обеспечивающие синтез новых соединений.Немецкие ученые Л. Михаэлис и М. Ментен установили, что первый этап ферментивного процесса – обратимая реакция между субстратом и ферментом с образованием промежуточного фермент–субстратного комплекса, второй этап – распад комплекса на продукт реакции и исходный фермент.
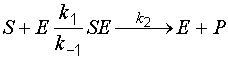 , (8.1)
, (8.1)
где S – субстрат; E – фермент; SE – фермент-субстратный комплекс; P – продукт реакции; k1, k–1 – константы скорости прямой и обратной реакции, k2 – то же для реакции распада комплекса.
8.1.3. Скорость ферментивной реакции
Как следует из формулы (8.1) скорость реакции обусловлена значениями констант k1, k–1 и k2.
Если скорость стабилизировалась, то это означает, что между свободной и связанной субстратом формами фермента возникло равновесное состояние. При нарушении такой ситуации скорость ферментивной реакции изменится: уменьшится при снижении концентрации субстрата и появления избытка свободных форм фермента или увеличится при повышении концентрации субстрата.
Скорость ферментивной реакции может рассматриваться как мгновенное изменение концентрации субстрата, т.е.
 . (8.2)
. (8.2)
По формуле Михаэлиса–Ментена:
m = mmax [S] / (km + [S]), (8.3)
где mmax – максимально возможная скорость реакции, достигаемая при полном насыщении фермента субстратом (рис. 8.2); [S] – концентрация субстрата; km = (k1 – k–1 + k2) / k1 – константа Михаэлиса.
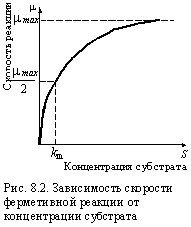 |
На рис. 8.2 приведен график, иллюстрирующий уравнение Михаэлиса–Ментена. Если m / mmax = 0,5, то km = [S], следовательно, константа Михаэлиса численно равна концентрации субстрата, при которой скорость реакции равна половине максимальной. Константа km характеризует ход ферментивной реакции. Значение km зависит от того, насколько легко поддается субстрат биохимической деструкции. Для устойчивых соединений константа Михаэлса имеет большие значения и достижение высокой скорости реакции требует больших концентраций субстакта. Для конкретного субстрата km = const только в случае, если концентрация биомасы постоянна. При увеличении концентрации, а следовательно, и количества вырабатываемых ею ферментов, значение km уменьшается. |
При избытке субстрата скорость реакции ограничивается содержанием фермента.
Степень влияния на скорость процесса концентраций фермента, субстратов и кислорода зависит от того, находятся ли они в избытке или в стехиометрическом соотношении с другими компонентами.
В присутствии токсичных примесей скорость реакции уменьшается, что следует учитывать введением понижающего коэффициента к значению m в формуле (8.3). Если токсическое воздействие оказывают продукты метаболизма самой клетки, скорость определяется по формуле Н.Д. Иерусалимского, учитывающей концентрацию биомассы:
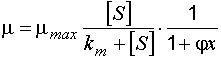 , (8.4)
, (8.4)
где x – концентрация биомассы, j – коэффициент ингибирования, зависящий от вида водных загрязнений. Например, для загрязнений городских сточных вод j = 0,07, стоков азотной промышленности j = 1,11, целлюлозно-бумажной промышленности j = 2,0 и т.д. [26].
8.1.4. Состав биоценозов
В сооружениях для биологической очистки воды формируется биоценоз, т.е. совокупность микроорганизмов, растений и животных, связанных между собой условиями совместной жизнедеятельности. Основную часть биологической массы биоценоза составляют микробы, генерирующие необходимые для очистки ферменты. К микробам относятся также лучистые грибки – актиномицеты. Микробы, а также водные грибки и дрожжи образуют первый трофический уровень организмов биоценоза (от греческого – питание). Источником питания для организмов первого уровня служит субстрат, разрушаемый в процессе очистки. Ко второму трофическому уровню относятся простейшие, источником питания которых являются организмы первого уровня. В свою очередь простейшие служат пищей для червей и личинок насекомых, – представителей третьего трофического уровня. Соотношение количества представителей каждого уровня находится в динамическом равновесии, поддерживаемом естественным путем. Считается, что при повышении трофического уровня на одну ступень, аккумулирование энергии в биологической массе снижается в 10 раз.
Биоценоз образуется естественным путем и при изменении влияния внешних факторов способен к саморегулировке. На этом основана его жизнеспособность и устойчивость. Чистые культуры микроорганизмов лишены этих свойств и быстро вырождаются. Применение бактериального метода очистки микроорганизмами, выращенными в искусственных условиях и адаптированными к определенным загрязнениям, например, углеводородам, предусматривает лишь однократное использование таких бактерий.




