7. ЭЛЕКТРОХИМИЧЕСКАЯ ОЧИСТКА
7. ЭЛЕКТРОХИМИЧЕСКАЯ ОЧИСТКА
7.1. Краткие сведения из теории
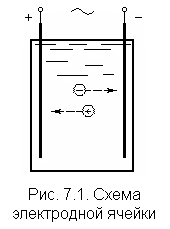 |
Электрохимическая очистка производится в электролизере, представляющем собой блок из параллельно расположенных электродных ячеек. Ячейка образована двумя электродами, присоединенными к разным полюсам источника постоянного электрического тока. Межэлектродное пространство заполнено очищаемой водой, которая всегда является электролитом, то есть проводником второго рода (рис. 7.1)
Движение электрического тока через электролит есть результат перемещения полярных частиц к электродам, имеющим противоположные знаки: к положительно заряженному аноду перемещаются отрицательно заряженные частицы, к отрицательно заряженному катоду – частицы с положительным зарядом. Основная роль в этом процессе принадлежит ионам (табл. 5.3). |
Между электродом и элекролитом возникает разность потенциалов, что делает принципиально возможными окислительно-восстановительные реакции (см. табл. 6.4). Продукты этих электродных реакций, а так же другие водные примеси, могут вступать между собой в химические взаимодействия. Химические реакции, происходящие в меж-электродном пространстве, называются объемными. Таким образом, электрохимическая очистка осуществляется в результате электродных и объемных процессов, причем первые полностью или частично инициируют вторые.
7.2. Разрушение молекул воды при электролизе
В результате электродных реакций происходит разрушение некоторого количества молекул воды с образованием продуктов, активно участвующих в объемных процессах. Непосредственно у электродов вода находится в неустойчивом состоянии. У анода мощность редокс–системы по кислороду r02 равна нулю, у катода нулевое значение имеет мощность по водороду rН2 (рис. 6.14).В зависимости от РН и потенциала Е происходят анодные реакции, сопровождающиеся выделением молекулярного кислорода, озона, пероксида водорода, т.е. сильных окислителей:
при E0=+1,23 В 2Н2О ↔ О2 + 4Н+ + 4е,
при E0=+2,07 В O2 + Н2О ↔ О3 + 2Н+ + 2е,
при E0=+1,77 В 2Н2О ↔ Н2О2 + 2Н+ + 2е.
В [22] высказывается мнение, что в при-анодном пространстве может образовываться анион Н3О2–, после окисления, которого следует ожидать появления атомарного кислорода. Анион Н3О2– возникает в результате разрыва связи между кислородом и водородом в молекуле воды, что требует создания больших напряжений.
У катода происходит восстановление молекулярного водорода:
при E0=+1,77 В 2Н+ +2ОН– ↔ 2Н2О + 2е.
Катодное восстановление катионов Н+ до молекулярного водорода идет по схеме
Н ↔ Н++е; Н + Н = Н2.
В кислой среде восстанавливается гидроксон
2Н3O+ + 2e ↔ Н2 + Н2O.
7.3. Электролиз хлоридов
Электролиз хлоридов позволяет получить все формы активного хлора: молекулярный, хлорноватистую кислоту и гипохлорит-ион. Эти окислители участвуют в соответствующих объемных процессах. При растворении поваренной соли, она диссоциируется, разделяясь на катионы натрия и анионы хлора. Последние окисляются у анода до молекулярного хлора:
при E0 = -0,87 В 2Cl– ↔ Cl2 + 2е.
В ходе дальнейших объемных процессов, в зависимости от pН, образуются другие формы активного хлора:
2Cl2 + 4OH– ↔ 2ClO– + 2H2O,
Cl2 + OH– ↔ HOCl + Cl–,
Cl2 + H2O ↔ HCl + HOCl.
Гипохлорит-ион также образуется в результате ряда реакций с участием катионов натрия:
Na+ + OH– ↔ NaOH,
NaOH + HCl = H2O + NaClO (гипохлорит натрия),
NaClO ↔ Na+ + ClO– (при РН >> 5).
Если гипохлорит-ион используется в объемных реакциях недостаточно интенсивно и накапливается в меж-электродном пространстве, происходит его анодное окисление с образованием малоактивного аниона ClO3–. Этот процесс будет превалировать, т.к. электродный потенциал конкурирующей реакции окисления Cl– до Cl2 меньше. Перевод хлора в малоактивное состояние, естественно нежелателен.
7.4. Электрохимическая деструкция водных загрязнений
Механизм очистки от хорошо диссоциирующихся кислот, щелочей, солей включает следующие этапы: диссоциацию, перемещение ионов к электродам, электродное окисление или восстановление. Деполяризованные ионы теряют водную оболочку и сорбируются, либо образуют новые молекулярные соединения.
Одновременно происходят различные объемные реакции.
Следует заметить, что при близких значениях потенциалов Е может возникнуть конкуренция между компонентами, участвующими в электродных реакциях.
Например, анодное разрушение молекул воды с образованием О2 происходит при Е0 = + 1,23 [В], а окисление Cl– до Cl2 – при +1,36 [В]. Поэтому, между этими процессами в области значений Е = +1,36–1,40 [В] происходит конкуренция и лишь при заметном увеличении Е окисление Cl– идет достаточно энергично.
Для устойчивого хода электродных процессов разность потенциалов на границе «электрод–электролит» следует увеличить сравнительно со значениями Е0 (табл. 6.4), т. е. создать перенапряжение. Оно необходимо для того, чтобы электроны преодолели сопротивление двойного электрического слоя, формирующегося на поверхности электрода.
На значение перенапряжения влияют многие факторы и, в первую очередь, материал электрода, активность его молекул (наибольшее перенапряжение требуется для электродов из свинца). Кроме того, перенапряжение зависит от плотности тока, т.е. его силы, отнесенного к единице площади поверхности электрода.
Значение перенапряжения находят по зависимости:
![]() E = a + b lg iel,
E = a + b lg iel,
где а и b – постоянные, зависящие от материалов электродов; iel – плотность тока.
Таким образом, выбор напряжений при электрической очистке предусматривает учет требуемых для данных реакций нормальных напряжений, перенапряжений и условий конкуренции между примесями.
Рассмотрим электрохимическую очистку воды от некоторых видов загрязнений.
7.4.1. Очистка от соединений циана
При электролизе щелочных сточных вод, содержащих комплексные и простые цианиды, последние окисляются на анодах с образованием цианатов:
CN– + 2OH– "CNO– + H2O + 2ē.
По мере накопления в растворе цианаты дополнительно окисляются и, взаимодействуя с параллельно деполяризующимися гидроксид-ионами, разрушаются до карбонат-аниона и газообразного азота:
2CNO– + 6OH– → 2HCO3 + N2↑ + 2H2O + 6ē.
При разрушении комплексных цианидов в воду поступают катионы металлов: кадмия, железа, меди и др. Перемещаясь к катоду и попадая в область восстановления они деполяризуются и осаждаются на катоде, либо взаимодействуя с анионами ОН– образуют гидроксиды, которые при соответствующих значениях рН в дальнейшем выпадают в осадок.
При генерации в электролизере активного хлора, он окисляет цианиды в ходе объемных реакций (см. главу 6).
7.4.2. Очистка от шестивалентного хрома и ионов тяжелых металлов
Восстановление шестивалентного хрома до трехвалентного осуществляется в электрокоагуляторах, электролизерах с растворимыми стальными анодами. Растворение анодов происходит в соответствии с реакцией: Fe· → Fe2+ + 2ē. Катионы двухвалентного железа частично окисляются до трехвалентного: Fe2+ → Fe3+ + ē и, Fe2+ + 2OH– → Fe(OH)2.
В основном же, окисление двухвалентного железа в трехвалентное происходит в результате объемных процессов и сопровождается восстановлением шестивалентного хрома до трехвалентного согласно реакциям:
Cr2O72– + 6Fe2+ + 14H+ → 6Fe3+ + 2Cr3+ + 7H2O.
В приведенных реакциях участвуют продукты электрохимического разрушения воды: Н+ и ОН–.
Восстановление шестивалентного хрома происходит у катода:
CrO42– + 4H2O + 3e → Cr(OH)3 + 5OH–,
Cr2O72– + 7H2O + 6e → 2Cr(OH)3 + 7OH–.
Для осаждения продуктов восстановления Fe(OH)3, Cr(OH)3, Fe(CrO4)2 необходима корректировка рН, исключающая растворение этих веществ.
Если в воде помимо хрома содержатся катионы других тяжелых металлов, то в ходе объемных процессов они восстанавливаются двухвалентным железом и осаждаются вместе с гидроксидами хрома и железа; часть этих металлов взаимодействуя с анионами ОН– переходят в малорастворимые соединения гидроксидов или, деполяризуясь на катоде, теряют гидратную оболочку и сорбируются на его поверхности.
Рекомендуемые значения рН, обеспечивающие удаление тяжелых металлов осаждением, приводятся в табл. 7.2.
Таблица 7.2
Рекомендуемые значения рН при удалении ионов тяжелых металлов
|
Компоненты |
Содержание Сr6+, мг/л |
рН |
|
Трехвалентный хром |
– |
3,5–4,0 |
|
Никель |
– |
Более 7,0 |
|
Медь, цинк, кадмий |
– |
Более 4,5 |
|
Шестивалентные хром, медь, цинк |
Менее 20 |
6–7 |
|
20–50 |
5–6 |
|
|
50–100 |
4–6 |
|
|
Шестивалентные хром, кадмий, никель |
Менее 50 |
6–7 |
|
Более 50 |
5–6 |
|
|
Шестивалентный хром |
Менее 50 |
6–7 |
|
Кадмий, никель |
Более 50 |
5–6 |
7.4.3. Электрохимическая деструкция органики
Процессы электрохимической деструкции органических веществ, обладающих ковалентными химическими связями, недостаточно изучены. Проф. И.Г. Краснобородько отмечал, что механизмы этих процессов должны выясняться применительно к конкретном органическом соединениям.
Часто при анодном окислении происходит частичное или полное расчленение органических молекул на отдельные фрагменты.
Так происходит окисление аниона муравьиной кислоты НСООН:
НСОО– ↔ Н + СО2 + е.
В зависимости от условий (рН, материал анода, перенапряжение, участие в анодных процессах деполяризованных, частиц и других) окисление идет разными путями с получением разных конечных продуктов. Например, уксусная кислота в щелочной среде окисляется на платиновом аноде по нескольким возможным схемам:
СН3СОО– + 3ОН– → СН3ОН + СО32– + Н2О + 2е,
2СН3СОО– + 4ОН– → С2Н6 + 2СО32– + 2Н2О + 2е,
СН3СОО– + 5ОН– → СН2О + СО32– + 3Н2О + 4е,
СН3СОО– + 11ОН– → 2СО32– + 7Н2О + 8е.
Анодное окисление спиртов сопровождается потерей водорода, т.е. дегидрированием.
В [18] отмечается, что катодное восстановление органики происходит под влиянием разных механизмов выделения водорода. В процессе могут участвовать как катионы, так и атомы водорода (после деполяризации Н+). Кроме того, в катодных реакциях участвует вещество самой органики, с образованием радикалов Rc в виде органических анионов Rc + e → Rc–, и дальнейшей гидратацией: Rc–+ H+ → Rc. Наконец, возможны при-катодные реакции по схеме: Rc + H + e → RcH. При высоких потенциалах у катодов образуются свободные радикалы, участвующие в тех или иных объемных процессах. Катодные процессы нередко вызывают замещение электроотрицательных функциональных групп органики водородом, т. е. образование новых соединений, менее устойчивых или не являющихся загрязнениями. В ряде случаев деструкция загрязнений начинается с катодного восстановления. Так ароматические соединения восстанавливаются у катодов до аминов, а затем подвергаются анодному окислению до образования воды, углекислого газа и молекулярного азота.
Особенностью электрохимической деструкции многих органических соединений с устойчивыми химическими связями является то, что электродные процессы только ослабляют связи и вызывают частичную деструкцию, а достаточно глубокое разрушение достигается в результате объемных окислительных процессов с участием соединений хлора.
Для деструкции некоторых устойчивых загрязнений необходим избыток активного хлора, накопление которого приводит к бесполезным потерям, т.к. на аноде он окисляется до малоактивного хлорат-иона ClO3–. В этих условиях целесообразно использование катализаторов, обеспечивающих разложение активного хлора с образованием атомарного кислорода, и свободных радикалов (см. п. 6.3.2.1).
И.Г. Краснобородько разработал основанный на этом метод электрокаталитической деструкции, обеспечивающий глубокое разрушении химически устойчивых веществ. Катализаторами могут служить соединения хрома, кобальта, никеля, марганца (см. п. 6.3.2.1).
Качество разных видов катализаторов оценивается по скорости каталитического разложения активного хлора. Наибольшая скорость разложения происходит при использовании оксида кобальта Со3О4, но это приводит к такому бурному выделению атомарного кислорода, что только часть его успевает использоваться по прямому назначению для окисления органики, а остальное количество после рекомбинации образует менее активный молекулярный кислород.
 |
Поэтому оказывается более целесообразным применять оксид никеля NiO или пиролюзит, представляющий собой смесь окислов марганца разной валентности, в основном четырехвалентного. Пиролюзит – природный материал, и его состав может в разных случаях различаться. Наличие в составе пиролюзита ионов марганца разной валентности следует рассматривать как положительный фактор, облегчающий электронные переходы при разложении активного хлора.
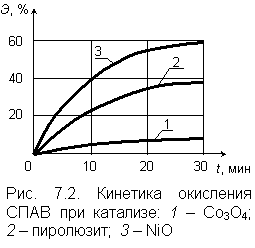
На рис. 7.2 приводится график, описывающий кинетику окисления анионогенного СПАВ при электрокаталитической очистке с применением разных катализаторов. Начальное содержание СПАВ составляло 22,3 мг/л. |
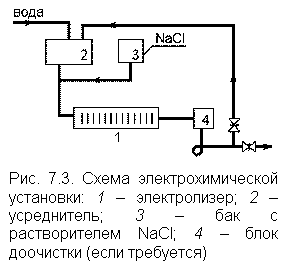 |
Принципиальная схема установки для электрохимической деструктивной очистки представлена на рис. 7.3. Основным элементом схемы является электролизер, который присоединен к источнику постоянного тока. Вода перед подачей в электролизер проходит усреднитель, т.к. изменения качества воды, и особенно значения рН, могут нарушить нормальную работу установки. Перед электролизером воду обрабатывают раствором NaCl дозами 0,5 г/л и более. Это делается для увеличения электропроводности воды и позволяет интенсифицировать объемные окислительные процессы с участием соединений хлора. В отдельных случаях (например, при деструкции цианидов) в электролизер подается сжатый воздух, чем достигается усреднение качества воды в межэлектродном пространстве и удаление выделяющихся при полной деструкции газов (азот, углекислый газ). Если при электрохимической обработке образуются нерастворимые примеси, например, при очистке от шестивалентного хрома, то после электролизера производится регенеративная очистка отстаиванием. |
Установки могут быть проточными, либо периодического действия с рециркуляцией воды.
На рис. 7.4. приведена принципиальная схема электрокаталитической очистки сточных вод красильно–отделочного производства. Сильнозагрязненный сток частично очищается в электролизере, содержит значительное количество активного хлора и направляется для доочистки в каталитический реактор после предварительного смешения со слабозагрязненным стоком. Таким образом, глубокая очистка достигается хлорированием в присутствии катализатора.
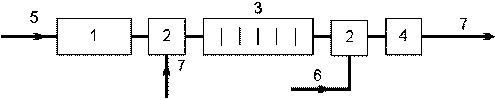
Рис. 7.4. Принципиальная технологическая схема электрокаталитической очистки сточных вод красильно-отделочного производства: 1 – усреднитель; 2 – смеситель; 3 – электролизер; 4 – каталитический реактор; 5 – сильно загрязненный сток; 6 – слабо загрязненный сток; 7 – раствор NaCl
Электролизер – это генератор продуктов для окисления и восстановления. Согласно закону М. Фарадея, теоретическое количество вещества, прореагировавшего на электродах при пропускании электрического тока, определяется по формуле:
G = AIcurt, (7.1)
где G – количество вещества, г; Icur – сила тока, А; t – продолжительность процесса, ч; А – электрохимический эквивалент вещества, г/Ач.
Электрохимический эквивалент равен:
А = М / 26,8z. (7.2)
где М – атомная масса элемента или молекулярная масса соединения, z – его валентность.
Пример 7.1. Определить удельный расход электричества, необходимый для восстановления шестивалентного хрома. М = 52,01, z = 6.
Решение.
1. Электрохимический эквивалент шестивалентного хрома:
А = 52,01 / (26,8∙6) = 0,323 г/Ач.
2. Удельный расход электричества, т.е. отнесенный к G =1г, равен:
qуд = 1/А = 1/0,323 = 3,09 Ач/г.
На кинетику электродных окисления и восстановления влияют плотность тока и продолжительность электролиза.
Плотность тока – его сила, отнесенная к единице площади электрода, анода или катода. В соответствие с этим, плотности тока могут быть анодными и катодными. Обычно, в расчетах используют анодную плотность, равную:
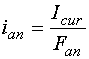 . (7.3)
. (7.3)
где Icur – сила тока, А; Fan – площадь анода (суммарная), м2.
Скорость прохождения электродных процессов, определяющая их кинетику, прямо пропорциональна плотности тока.
С увеличением ian возрастает и степень деструкции. Вместе с тем, плотность тока ограничивается по условиям турбулизации потока воды в межэлектродном пространстве. С увеличением плотности тока возрастает газовыделение, происходит энергичное перемешивание воды, размывается прианодный слой, где накапливается наиболее активное соединение хлора. Таким образом, хотя плотность тока непосредственно влияет только на электродные процессы, но косвенно сказывается на ходе объемных реакций. С увеличением продолжительности электролиза эффект очистки монотонно повышается и имеет тенденцию к стабилизации. Чем выше плотность тока, тем быстрее достигается максимальный эффект очистки.
В некотором интервале значений плотности тока, от минимального, при котором происходит устойчивая очистка, и приблизительно до 80–100 А/м2 затраты электроэнергии на единицу объема воды зависят только от достигаемого эффекта очистки.
При проектировании электролизеров расчетными характеристиками аппаратов являются полезная вместимость и площадь электродов.
Полезная вместимость определяется по зависимости: Wп = qwt, где qw – производительность (расчетный расход воды), t – продолжительность электролиза по экспериментальным данным.
Величину силы тока определяем из формулы 7.1: Icur = G/At.
Площадь анодов: Fan = Icur/ian, где iап – плотность тока по экспериментальным данным.
В тех случаях, когда продолжительность электролиза велика, предусматривается схема с многократной рециркуляцией очищаемой воды, либо электролизер конструируется с лабиринтным движением воды. Аппарат работает следующим образом. Вода через штуцер 8 поступает в первую ячейку и движется справа налево, затем через отверстия 1 в электроде попадает во вторую ячейку и т.д. Методика расчета таких аппаратов приведена в [18, 23].
Более подробно о расчетах и конструкциях электролизеров в [24].




