6.3.4. Аппаратура для очистки воды окислением и восстановлением
6.3.4. Аппаратура для очистки воды окислением и восстановлением
В тех случаях, когда реагенты (окислители или восстановители) применяют в виде водных растворов (хлорная вода, растворы пероксида водорода, перманганата калия, сульфита натрия и др.) технологическая схема включает смеситель, реактор и, если это необходимо, установку доочистки. Конструкция аппаратов, предназначенных для использования газообразных реагентов (кислород воздуха, технический кислород, озон, двуокись серы), должны обеспечивать благоприятные условия растворения газов. Интенсивность растворения зависит от степени предварительного диспергирования вводимых газов, температуры, давления и некоторых других факторов.
Кислород воздуха растворяется в воде достаточно интенсивно. При разбрызгивании воды и падении капель с высоты 2 м происходит практически ее полное насыщение кислородом (табл. 6.6).
Таблица 6.6
Влияние высоты расположения душевой насадки
на степень обогащения воды кислородом [10]
|
Высота падения капель, см |
10 |
25 |
50 |
100 |
200 |
|
Обогащение кислородом воды в % от насыщения при атмосферном давлении и данной температуре |
40,5 |
45,5 |
52,0 |
79,0 |
85,0 |
|
То же при Т = +10 °С в мг/л |
4,0 |
4,4 |
5,0 |
7,8 |
9,5 |
В тех случаях, когда потребность в кислороде невелика, условия аэрации воды предельно упрощаются. Выше упоминалось, что стехиометрический расход кислорода на окисление 1 мг двухвалентного железа в трехвалентное равен 0,143 мг. Поэтому в установках по обезжелезиванию воды упрощенной аэрацией, которые применяются при содержании железа до 10 мг/л, достаточное насыщение кислородом достигается в результате свободного излива воды с высоты около 0,5 м.
Насыщение кислородом легко обеспечивается путем эжекции воздуха, барботажем, а также аэрацией воды с использованием градирен или брызгальных бассейнов (рис. 6.26).
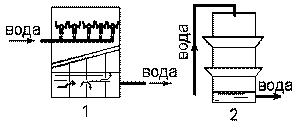
Рис. 6.26. Схемы реакторов для насыщения кислородом: 1 – брызгальный бассейн; 2 – градирня; 3 – резервуар с барботированием; 4 – змеевик-реактор
В тех случаях, когда необходимо достичь большего содержания кислорода в воде, сравнительно с полным насыщением при атмосферном давлении и оптимизировать условия окисления, в реакторе поддерживается повышенное давление и предусматривается перемешивание воды и воздуха. Одним из вариантов такого реактора является змеевик, при прохождении, по которому кислород воздуха окисляет горячие серосодержащие стоки целлюлозно-бумажного предприятия [12].
Реактор работает в режиме рециркуляции, что позволяет выдержать требуемую продолжительность контакта кислорода с окисляемыми примесями.
Особенностью реакторов для окисления озоном, является создание условий экономного использования этого дорогостоящего реагента. Задача заключается в максимальном ускорении процесса, т.к. озон достаточно быстро разлагается. Скорость саморазложения зависит от температуры, рН и солевого состава воды и описывается экспоненциальной зависимостью:
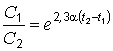 , (6.11)
, (6.11)
где С1, С2 – остаточный озон в воде для моментов времени t1 < t2; a – константа скорости саморазложения.
Продолжительность пребывания в реакторе складывается из времени растворения озона в воде и продолжительности непосредственно химических реакций. При прочих равных условиях важно максимально ускорить растворение. Скорость массопередачи, при переходе озона из газообразной фазы в растворенную, зависит от коэффициента диффузии, площади поверхности раздела газообразной и жидкой фаз, разности парциальных давлений по обе стороны границы раздела фаз. На рис. 6.27 приводятся графики, иллюстрирующие влияние некоторых факторов на растворимость озона в воде [4]. Растворимость резко падает при повышении температуры воды. Особенно это заметно в интервале температур от 0 до 20 °С. Повышение давления однозначно увеличивает растворимость и тем значительнее, чем выше концентрация озона в смеси. В [8] по этому поводу отмечается: «Если рассматривать вопрос только с точки зрения растворимости, выгодно до предела увеличивать концентрацию озона в озонированном воздухе. Но, когда скорость потребления озона постоянна, а концентрация повышается, возрастает мощность, потребляемая озонатором, и значительно уменьшается поверхность раздела на границе «вода – пузырьки» вследствие снижения объема последних».
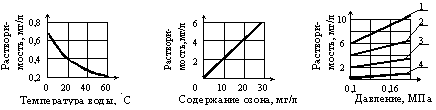
Рис. 6.27. Растворимость озона в воде в зависимости от разных факторов (температура, содержание в воздушно-озонной смеси, давление):
1 – для содержания озона в смеси 15 мг/м3; 2 – то же 10 мг/м3; 3 – то же 5 мг/м3; 4 – то же 1 мг/м3
Таким образом, растворимость озона должна оптимизироваться путем регулирования значений рассмотренных факторов.
Реакторы герметизируются, т.к. абгаз (газ, выделяющийся из воды после озонирования) всегда содержит некоторое количество неиспользованного озона, являющегося токсичным веществом. Абгаз должен обезвреживаться химическим или термическим методами.
Особенно много озона остается неиспользованным при его низком содержании в озоновоздушной смеси.
Разнообразные конструкции реакторов для озонирования можно разделить на одно- и многокамерные, а также реакторы-змеевики (рис. 6.28).
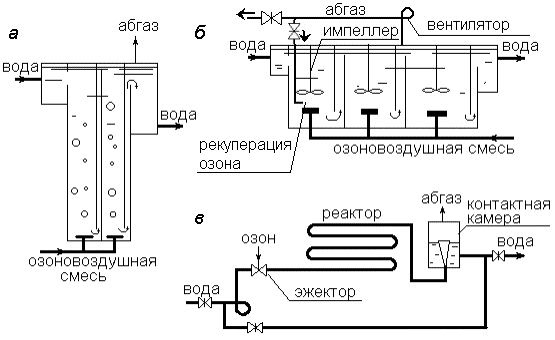
Рис. 6.28. Схемы реакторов для озонирования: а – колонна; б – напорный резервуар; в – реактор-змеевик
Реакторы–колонны имеют рабочую высоту до 6–8 м, и этот столб воды создает у дна абсолютное давление 0,16–0,18 МПа, что достаточно для растворения 80–90 % озона, который подается снизу. В многокамерных колоннах вода движется из одной камеры в другую последовательно, а озоновоздушная смесь подается в каждую камеру раздельно, по параллельной схеме (рис. 6.28, а). Такая схема позволяет полнее использовать озон, особенно если длительность процесса окисления велика. В этом случае, в каждой камере окисляются примеси, преимущественно находящиеся в разных состояниях: в первой камере – в исходном, в других – в виде промежуточных продуктов окисления. Многокамерные колонны могут оборудоваться системой рекуперации озона путем рециркуляции абгаза. Напорные резервуары имеют меньшую высоту, чем колонны (2–3 м) и в них поддерживается давление, достаточное для растворения озона. Как и колонны, резервуары могут быть одно- и многокамерными с последовательным движением воды и параллельным введением озоновоздушной смеси. Резервуары оборудуются системами рекуперации озона.
Реакторы-змеевики следует применять для озонирования воды, содержащей легко окисляющиеся примеси. Установки с такими реакторами периодического действия и работают в режиме рециркуляции воды.
Для интенсификации массообмена площадь раздела водной и газовой фаз должна быть максимальной. С учетом такого требования озоновоздушная смесь, поступающая в реактор, диспергируется. Диспергирование достигается подачей смеси через фильтросы или различные пористые перегородки, перемешиванием импеллером и другими диспергаторами.
Если при окислении не образуется значительного количества грубодисперсных примесей, вызывающих засорение, в колоннах размещается насадка: кольца Рашига и другие. Насадка улучшает контакт водных загрязнений с озоном, а на ее поверхности окисление происходит энергичнее, чем в объеме. Применимы активные загрузки (силикагель, графит, активированный уголь и другие).
На рис. 6.24 приведена схема реактора с загрузкой из железной стружки, состоящего из двух секций [18]. Как отмечалось выше, при подаче в реактор воды, подкисленной серной кислотой, в нем создаются условия для восстановления примесей. Вода проходит слой загрузки в первой секции сверху вниз, а затем, через вторую секцию в направлении снизу вверх. Выделяющиеся газы отводятся из реактора при помощи бортового отсоса (на рисунке не показан). Выгрузка стружки во время ремонтов производится через люки. Осадок, который накапливается в пирамидальной части реактора, периодически удаляется. Взамен обычного для такого рода реакторов барботажа воздухом, интенсифицирующего процесс растворения железа, предусмотрена пульсация фильтрующегося через загрузку потока. Для этого в первой секции реактора предусмотрена герметическая крышка, под которую по прерывистому режиму подается сжатый воздух, что вызывает низкочастотные колебания скоростей в потоке.
Проф. И.Г. Краснобородько, анализируя условия функционирования реактора, отмечал, что его эффективность оценивается двумя показателями: продолжительностью контакта кислоты с железом t и выходом железа RFe, т.е. отношением количества растворенного железа к теоретически возможному [18].
Для определения этих показателей были предложены следующие формулы:
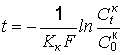 , (6.12)
, (6.12)
![]() , (6.13)
, (6.13)
где С0к и Сtк – содержание кислоты в начале процесса и по истечении времени t; Кк – константа скорости убывания концентрации кислоты, зависящая от температуры, С0К и F; F – удельная поверхность контакта железа и кислоты.
Для увеличения удельной поверхности следует загружать в реактор достаточно большую массу железной стружки.
В реакторах установки «Кристалл» [19] вместо стружки используется железный порошок, имеющий значительно большую поверхность, чем стружка.
6.4. Перевод растворенных примесей в труднорастворимые формы
6.4.1. Общие сведения
Труднорастворимые неорганические примеси образуются в результате высаливания или химических реакций. Растворимые органические вещества переводятся в нерастворимое состояние после деструкции, а так же методами полимеризации или поликонденсации.
Труднорастворимые продукты удаляются из воды известными методами регенерации (осаждение, процеживание и др.).
Эффективность процесса обусловлена степенью растворимости этих продуктов. Как известно, при прочих равных условиях растворимость зависит от температуры воды и значения рН.
Труднорастворимыми считаются вещества, образующие насыщенные водные растворы с концентрацией не более 30 г/л, а очень трудно растворимыми – с концентрациями от 1,0 до 0,1 г/л. Вещества, образующие насыщенные растворы с концентрацией менее 100 мг/л, условно считаются нерастворимыми. Для неорганических соединений с электронными химическими связями ориентировочной характеристикой труднорастворимого продукта считается произведение растворимости ПР.
Пусть соединение ВА состоит из катиона «В» с валентностью «n» и аниона «А», имеющего валентность «m». Тогда величина ПР при рН=const для этого вещества:
ПР = [Вn+][Аm–] = const. (6.14)
Значения ПР для некоторых соединений при значениях рН, отвечающих наименьшей степени растворимости, приведены в табл. 6.7.
Таблица 6.7
Значение ПР для некоторых соединений при 25 °С
|
Наименование |
Формула |
ПР |
|
Гидроксид алюминия |
Al(OH)3 |
1,9×10–33 |
|
Углекислый барий |
BaCO3 |
8,0×10–9 |
|
Углекислый кальций |
CaCO3 |
4,8×10–9 |
|
Гидроокись кальция |
Ca(OH)2 |
3,1×10–5 |
|
Сернокислый кальций |
CaSO4 |
6,1×10–5 |
|
Гидроксид хрома |
Cr(OH)3 |
10–30 |
|
Гидроксид меди |
Cu(OH)2 |
5,6×10–20 |
|
Гидроксид железа |
Fe(OH)3 |
4,0×10–33 |
|
Гидрат закиси железа |
Fe(OH)2 |
4,8×10–16 |
|
Наименование |
Формула |
ПР |
|
Фтористый кальций |
CaF2 |
4,0×10–11 |
|
Фтористый магний |
MgF2 |
6,0×10–9 |
|
Углекислый марганец |
MnCO3 |
10–10 |
|
Углекислый никель |
NiCO3 |
1,4×10–7 |
|
Углекислый свинец |
PbCO3 |
1,5×10–13 |
|
Углекислое железо |
3FеCO3 |
2,5×10–11 |
|
Гидроксид цинка |
Zn(OH)2 |
5,0×10–17 |
Чем меньше ПР, тем труднорастворимее вещество.
Растворимость вещества можно определить по произведению растворимости:
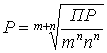 . (6.15)
. (6.15)
Если коэффициенты активности ионов существенно отличаются от единицы (см. п. 6.1) в расчетах следует использовать не произведение растворимости, а произведение активности:
ПА=fBnfAmПР, (6.16)
где fB, fA – коэффициенты активности катионов и анионов.
Концентрация исходного вещества в воде:
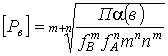 . (6.17)
. (6.17)
Соответственно концентрации катионов В и анионов А в воде находятся по формулам:
катионов 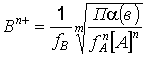 , (6.18а)
, (6.18а)
анионов 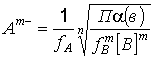 . (6.18б)
. (6.18б)
6.4.2. Высаливание
Высаливание заключается в обработке воды хорошо растворимым реагентом (высаливателем), в результате чего из раствора выделяется высаливаемое вещество (загрязнитель) вследствие повышения активности последнего [20].
Из формулы (6.10) следует, что, увеличивая в растворе содержание одного из ионов можно, соответственно, уменьшить содержание другого. Например, увеличивая содержание аниона, уменьшаем содержание катиона.
Для иллюстрации приведем пример, заимствованный из [21].
Пример 6.5. Для очистки сточной воды от фтора в нее был введен катион Са2+ в стехиометрическом соотношении. В результате реакции образовался фтористый кальций СаF2. Определить содержание фтора в воде после очистки, если ионная сила раствора I = 0,01.
Решение.
1. По табл. 6.1 находим значение коэффициентов активности: для кальция fВ = 0,66, для фтора fА = 0,9.
2. По табл. 6.7 определяем ПР для СаF2; ПР = 4·10–11.
3. По (6.16) определяем Пa = 4·10–11·0,66·(0,9)2 = 2,14·10–11.
4. Определяем остаточную растворимость СаF2, по формуле (6.17).
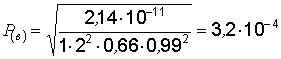 моль/л.
моль/л.
5. Определяем остаточную концентрацию фтора. Молекула СаF2 при диссоциации образует один ион (катион) кальция и два иона (аниона) фтора. Следовательно:
РCaF2 = [Са2+] = 0,5 [F–] .
Отсюда: [F–] = 2РCaF2 = 2·3,2·10–4 = 6,4·10–4 г–ион/л.
Эквивалентный вес г–иона фтора равен 19г.
Таким образом, концентрация фтора в воде после очистки равна: 19·6,4·10–4 = 12,2 мг/л.
Заметим, что при обработке воды стехиометрическими дозами кальция глубокая очистка от фтора не достигается. Для этого следует применять избыточные дозы кальция.
Пример 6.6. Определить избыточную (сверх стехиометрической) дозу извести с тем, чтобы содержание фтора в воде уменьшилось до 0,001 г/л. Остальные условия как в предыдущей задаче.
Решение.
1. Определить допустимое остаточное содержание фтора в г–ион/л.
0,001/19 = 5,25·10–5 г–ион/л.
2. Определяем избыточную дозу катионов кальция.
По формуле 6.13:
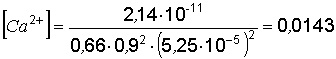 г-ион/л.
г-ион/л.
Эквивалентный вес 1 г-иона равен 20 г. Избыточная доза кальция:
20 · 0,0143 = 0,29 г/л = 290 мг/л.
6.4.3. Образование труднорастворимых соединений тяжелых металлов
Ионы тяжелых металлов могут переводиться в труднорастворимое состояние сульфидов, карбонатов и гидроксидов.
Часто в качестве реагента используется сернокислый натрий:
ZnSO4 + Na2S = ZnS + Na2SO4;
Hg(NO3)2 + Na2S = HgS + 2NaNO3.
Продукты реакции (сернистый цинк и сернистая ртуть) мало растворимы.
Труднорастворимые карбонаты меди, никеля, железа, свинца и других тяжелых металлов получают путем обработки воды кальцинированной содой:
2CuSO4 + 3Na2CO3 + 2H2O = (CuOH)2CO3¯ + 2NaHCO3.
Гидроксиды металлов образуются в зависимости от окислительной мощности редокс-системы, путем подщелачивания воды щелочью (например, едким натром) с одновременной регулировкой значения Е.
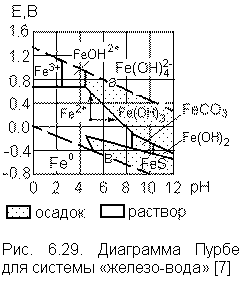 |
Для выбора целесообразной схемы обработки воды полезно использовать диаграммы Пурбе. На диаграммах «Е–рН» систем «металл–вода» обозначены области преобладающего присутствия тех или других соединений металлов, образовавшихся в результате их химического взаимодействия с водой или с продуктами ее распада (протоны, анионы ОН–). Для случаев образования нескольких разных ионов составлены уравнения равновесия между ними, а также частные случаи этих уравнений, когда активности ионов, находящихся в смежных областях, равны между собой. Уравнения отнесены к разграничительным линиям, разделяющих области преимущественного нахождения тех или иных форм металлов. На рис. 6.29 приводится в упрощенном виде диаграмма «железо-вода». Железо в области термодинамической устойчивости воды находится в форме катионов Fe2+, Fe3+, FeOH2+, ионов HFeO2–, а также в виде закиси Fe(OH)2 и гидроксида Fe(OH)3. В [1] приведены диаграммы «Е–рН» для редокс–систем с присутствием железа, алюминия, магния, марганца и уравнения для построения разделительных линий. |
Диаграммы лишь приблизительно отражают фактические ситуации, т.к. составлены для условной схемы взаимодействия химически чистой воды только с одним элементом. В действительности, обрабатываемые растворы одновременно содержат большое количество разнообразных примесей. Однако, при помощи диаграмм можно с достаточной достоверностью идентифицировать форму, в которой находится металл по результатам измерения рН и Е. Кроме того, основываясь на диаграммах, можно обосновать технологию обработки воды с целью получения нужной формы.
Пусть, например, при анализе воды, содержащей железо, рН = 5, а Е = + 0,1 В. Из диаграммы на рис 6.29 ясно, что железо находится в форме катиона Fe2+. Труднорастворимый гидроксид можно получить разными путями: подщелачиванием воды до рН ≥ 7 – 8, повышением окислительного потенциала до + 0,5 В и более, либо путем комбинации этих двух приемов.
Для некоторых металлов перевод в форму гидроксида не зависит от Е и достигается только корректировкой рН воды. Например, Al3+ переходит в Al(OH)3 при рН от 2 до 14,5 и концентрация катиона Al3+ в этой области находится по формуле lg[Al3+] = 9,66 – 3рН; при рН более 14,5 алюминий присутствует в форме аниона AlO2–, причем, при меньших значениях рН содержание аниона находится по формуле: lg[AlO2–] = –10,64 + рН.
Гидроксид меди, как и гидроксиды цинка или алюминия, является амфолитом, т.е. обладает амфотерными свойствами и хорошо растворяются как в кислотах, так и в щелочах, а область рН, в которой он нерастворим, мала (рН = 8 – 10). Перевод амфолитов в нерастворимое состояние целесообразно производить путем получения не гидроксида, а другого малорастворимого соединения.
Значения рН, при которых гидроксиды имеют наименьшую растворимость для разных элементов, существенно различаются (табл. 6.8).
Таблица 6.8
Растворимость некоторых гидроксидов в зависимости от рН воды
|
Гидроксиды |
Fe(OH)3 |
Al(OH)3 |
Cr(OH)3 |
Zn(OH)2 |
Co(OH)2 |
Ni(OH)2 |
Cd(OH)2 |
|
|
рН |
Нерастворим более |
4,1 |
5,2 |
6,8 |
8,0 |
9,2 |
9,5 |
9,7 |
|
Начало растворения |
14,0 |
7,8 |
12,0 |
10,5 |
14,1 |
– |
– |
|
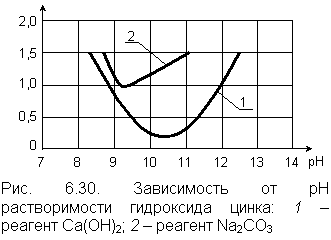 |
Растворимость образующихся при подщелачивании осадков зависит от вида применяемого щелочного реагента. Это подтверждается графиками зависимости от рН растворимости гидроксида цинка, полученного в результате подщелачивания воды известковым молоком (едким кальцием) и карбонатом натрия. В последнем случае образуется осадок в виде соединения ZnCO3·Zn(OH)2·H2O. Область рН, в которой этот осадок нерастворим, значительно уже (рис. 6.30). Удельные затраты основных щелочных реагентов, необходимые для перевода тяжелых металлов в труднорастворимое состояние, приведены в табл. 6.9. |
Таблица 6.9
Удельные затраты реагентов, г/г
|
Металл |
Реагенты |
|||
|
CaO |
Ca(OH)2 |
Na2CO3 |
NaOH |
|
|
Zn2+ |
0,85 |
1,13 |
1,60 |
1,22 |
|
Ni2+ |
0,95 |
1,26 |
1,80 |
1,36 |
|
Cu2+ |
0,88 |
1,16 |
1,66 |
1,26 |
|
Fe2+ |
1,00 |
1,32 |
1,90 |
1,45 |
|
Pb+ |
0,27 |
0,36 |
0,51 |
0,32 |
Соли кальция мало растворимы в воде и это позволяет очищать воду от многих растворимых примесей методом известкования. Так, например, можно очистить воду от фторводородной кислоты НF и кремнефтороводородной кислоты Н2SiF6 и их солей. В случае применения в качестве реагента известняка проходят следующие реакции:
– на первом этапе Na2SiF6 + CaCO3 → CaSiF6 + Na2CO3,
– на втором этапе CaSiF6 + 2CaCO3 = 3CaF2↓ + SiO2↓ + 2CO2↑
2HF + CaCO3 = CaF2↓ + CO2↑ + H2O,
в случае применения Са(ОН)2:
2HF + Ca(OH)2 = CaF2↓ + 2H2O,
Na2SiF6 + 3Ca(OH)2 = 3CaF2↓ + SiO2↓ + 2H2O + 2NaOH.
Произведение растворимости фторида кальция СаF2 равна 4·10–11. При рН = 10–11 в малорастворимые кальциевые соли переводятся фосфаты:
2РО43–+3Са2+ = Са3(РО4)2 ¯.
Соли мышьяковистой и мышьяковой кислот при известковании переводятся в малорастворимые соли кальция:
2AsO42– + 3Ca2+ = Ca3(AsO4)2 ¯
2AsO33– + 3Ca2+ = Ca(AsO3)2¯.
Для выделения некоторых органических примесей их переводят в другие соединения с меньшей растворимостью. Например, для очистки от такого нитросоединения, как хлорпикрин, используется метод восстановления до удаляемого простой отгонкой метиламина.
Если вода загрязнена органическими примесями, склонными к полимеризации, то этот прием может быть использован в очистке. Процесс идет в присутствии веществ–инициаторов, являющихся либо составной частью будущего полимера, либо играющих роль катализаторов.
Так при обработке гидроксидом кальция воды, загрязненной формальдегидом, возникает полимеризация с образованием нерастворимой гексозы:
СН2О + СН2О = СН2ОН – СНО
СН2ОН – СНО – СН2О = СН2ОН – СНОН – СНО.
Ход процесса зависит от температуры и рН воды, а также от состава и концентрации примесей.
Поликонденсация, т.е. полимеризация с выделением побочного низкомолекулярного вещества, применяется для очистки от фенолов и формальдегидов с образованием нового продукта, – нерастворимых формальдегидных смол. Процесс инициируется кислотной или щелочной обработкой воды, проходит при высоких температурах и давлениях.
Для очистки воды от масляной, уксусной и других низкомолекулярных карбоновых кислот применяется следующая технология: вода смешивается со спиртами и обрабатывается минеральными кислотами, содержащими гидроксоний Н3О+, который является катализатором. Загрязнения переводятся в форму сложных эфиров и удаляются отгонкой. Обычно используются этиловый или бутиловый спирт и серная кислота.




