6.3.2.4. Озонирование
6.3.2.4. Озонирование
Озон – сильнейший окислитель. В реакции О3 + 2Н+ + 2ē ↔ О2 + Н2О окислительно-восстановительный потенциал равен +2,07 [В]; в щелочной среде Е0 = 1,24 [В].
Взаимодействие озона с водой происходит поэтапно и медленно и завершается образованием молекулярного кислорода. На промежуточных этапах выделяются анионы ОН–, каталитически усиливающие окислительные процессы с участием О2.
Окисление сопровождается потерей озоном атома кислорода или внедрением молекул О3 в окисляемое вещество (процесс ознолиза).
Примером первого вида окисления служит деструкция цианидов (см. ниже).
Озонолиз происходит при разрушении органических соединений, например, гуминовых кислот, придающих воде цветность. Как отмечается в [1], озонолиз приводит к разрыву молекул гумуса и разрушению хромоформных групп с образованием более простых и менее окрашенных соединений. Гуминовые кислоты превращаются в апокреновые, затем в креновые и, наконец, в малоокрашенные кислоты (субкреновая, уксусная, щавелевая).
В зависимости от окислительно-восстановительного потенциала или рН, факторов определяющих окислительно-восстановительную мощность системы (см. рис. 6.14) процесс окисления озоном, как и многие другие процессы окисления и восстановления, могут идти по разным маршрутам и приводить к образованию разных конечных продуктов.
Окисление сероводорода озоном завершается образованием двуокиси серы, а при больших дозах озона и больших значениях rH2 – серной кислоты. В первом случае двухвалентная сера окисляется до четырехвалентной, во втором – до шестивалентной.
H2S + O3 = SO4 + H2O,
3H2S + 4O3 = 3H2SO4.
Оба процесса идут одновременно, но чем больше доза озона, тем более превалирует второй. Двухвалентный марганец окисляется до четырехвалентного или шестивалентного в зависимости от концентрации озона в воде:
MnSO4 + O3 + 2H2O = H2MnO3 + O2 + H2SO4,
2MnSO4 + 5O3 + 2H2O = 2MnO4 + 5O2 + 2H2SO4.
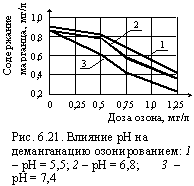 |
Интенсивность деманганации (удаления марганца) усиливается при увеличении рН, что так же как увеличение дозы О3 приводит к росту мощности редокссистемы (рис. 6.21). Как следует из рисунка, даже небольшое изменение рН существенно влияет на результаты очистки. Рассмотрим окисление озоном цианидов. Значение рН принимается 10–13. Влияние температур воды на динамику окисления минимально, удельная доза озона составляет 4 мг/мг цианида (стехиометрическая доза 3,37 мг/мг). Процесс проходит в два этапа: с образованием цианатов и до полного разрушения: 1. CN– + O3 = CNO– + O2; 2. 2CNO– + 3O3 + 2OH– = 2CO32– + N2↑ + 3O2 + H2O. |
На первом этапе удельный расход озона составляет 1,85 мг/мг. Повышение рН воды до 13 увеличивает скорость окисления почти в 7 раз сравнительно с рН = 10,5, но приводит к значительному росту дозы озона – до 11,6 мг/мг. Последнее обстоятельство объясняется тем, что в щелочной среде происходит интенсивное саморазложение озона.
При более низких значениях рН (до 5 и менее) и уменьшения мощности редокссистемы, идет двухэтапный процесс восстановления цианитов до мочевины:
![]() ;
;
![]() .
.
Условия озонирования зависят от озоностойкости окисляемых водных примесей. В [14] приводится следующая классификация примесей по озоностойкости:
– к первой группе (легко взаимодействующие вещества) отнесены: гуминовые кислоты, фенолы, соединения серы, двухвалентное железо, патогенные микроорганизмы, некоторые виды вирусов;
– ко второй группе (умеренно взаимодействующие) относятся: коллоидально диспергированные фульвокислоты, некоторые виды СПАВ, альдегиды, кетоны, часть нефтепродуктов, органические соединения, содержащие функциональные группы NH, ОН, СНО, S, SH, некоторые виды вирусов;
– к третьей группе (трудно взаимодействующие) следует отнести: предельные углеводороды, некоторые виды СПАВ, пестициды, красители, спорообразующие микроорганизмы.
При озонировании загрязнений первой группы процесс идет достаточно быстро, дозы озона близки к стехиометрическим, но при глубокой деструкции их все же следует увеличивать.
Ход процесса оптимизируется правильным назначением рН воды.
При озонировании воды, содержащей примеси, умеренно взаимодействующие с озоном, для достижения высокого эффекта очистки процесс следует интенсифицировать как за счет корректировки рН, так и введением избыточного (сравнительно со стехиометрическими дозами) озона. Кроме того, в этих случаях желательно применение катализаторов – металлов с переменной валентностью.
 |
Интенсификация процесса особенно важна при очистке от трудновзаимодействующих загрязнений. На рис. 6.22 иллюстрируется кинетика окисления нефтепродуктов и ХПК сточных вод нефтеперерабатывающего завода после предварительной механической и биологической очистки. Можно заключить, что если за счет оптимизации рН удалось достичь увеличения скорости окисления примесей, определяющих ХПК, то эффективность этого фактора в отношении только нефтепродуктов оказалась менее значительной. Активированные угли аккумулируют озон и способствуют более рациональному его использованию. Например, при окислении на активированных углях сероводорода и меркантанов затраты озона уменьшились в 1,5…2,0 раза [15]. Применение системы «озон–пероксид водорода» позволяет генерировать свободные радикалы: |
Н2О2 → Н+ + НО2;
НО2· + О3 → НО· + О2 + О2·.
Совместное применение двух окислителей (О3 и Н2О2) обеспечивает деструкцию озоноустойчивых примесей при значительно меньших дозах озона, чем это потребовалось бы только при одном озонировании.
Фотолиз воды многократно повышает интенсивность процесса окисления, т.к. образуются свободные радикалы:
О3 + Н2О ![]() О2+Н2О2 ;
О2+Н2О2 ;
Н2О2 ![]() 2НО· (свободный радикал).
2НО· (свободный радикал).
В [5] высказывается мысль, что поскольку в условиях фотолиза не фиксируется накопление пероксида водорода, параллельно с образованием свободных радикалов происходит реакция между пероксидом и озоном:
Н2О2 + О3 → Н2О + 2О2.
Окисление усиливается в присутствии катализаторов (оксиды меди, марганца, кобальта, никеля и их композиции). Носителями этих окислов могут быть силикогель, алюмосиликаты, бентонитовые глины и другие [16]. Например, очистка воды от тетраэтилсвинца озонированием проводится в колонне, загруженной силикогелем. Образующиеся окислы свинца, оседая на силикогеле, являются катализаторами и дополнительно интенсифицируют процесс.
6.3.2.5. Применение других окислителей
При окислении водных примесей соединениями многовалентного марганца, последний восстанавливается до двухвалентного и является акцептором электронов. Так, окисление фенола четырехвалентным марганцем протекает в кислой среде по следующим уравнениям:
С6Н5ОН + 14MnO2 + 14H2SO4 → 6CO2 + 17H2O + 14MnSO4
или при использовании окислителя полуторооксида марганца
C6H5OH + 14Mn2O3 + 28H2SO4 → 6CO2 + 31H2O + 28MnSO4.
Соли марганца затем регенерируются щелочной обработкой и окислением с использованием кислорода воздуха в качестве акцептора электрона:
MnSO4 + 2NaOH → Mn(OH)2 + Na2SO4;
2Mn(OH)2 + O2 → 2H2MnO3.
К сильным окислителям относится семивалентный марганец в виде перманганата калия: KMnO4.
В слабокислой или нейтральной среде перманганат калия окисляет сульфиды до нерастворимой серы, а сам восстанавливается до двух- и четырехвалентного.
При рН ~ 7,0 пермангант калия окисляет органику, восстанавливаясь при этом до диоксида марганца:
МnО4– + 2Н2О + 4е ® МnО2 + 4ОН–.
Так, кетоны окисляются до карбоновых кислот и, более глубоко, до углекислого газа. Например, реакция окисления щавелевой кислоты идет по уравнению:
2КМnО4 + 5Н2С2О4+ 3Н2SО4 = 10СО2 + 2МnSО4 + К2SО4 + 8Н2О.
Карбоновые кислоты могут быть разрушены перманганатом калия до минеральных составляющих.
В отдельных случаях для окисления применяется селитра: калиевая KNO3 или натриевая NaNO3. В [17] приводится схема деструктивной обработки селитрой концентрированного стока, содержащего органические соединения ртути. Ртуть переводится в ионное состояние.
К акцепторам электронов относится протон Н+, который восстанавливается до атомарного водорода.
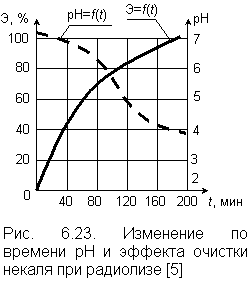 |
Выше мы рассмотрели примеры генерации свободных радикалов химическим путем и отметили, что они являются чрезвычайно активными окислителями. Генерация свободных радикалов может осуществляться и при радиационном облучении (радиолизе) воды. В результате радиолиза вода насыщается такими свободными радикалами, как НО2· и О2·. При помощи радиолиза можно создать оптимальную редокс–систему. В качестве источников радиации применяют Со60 и Сs137. В [5] приводятся примеры применения радиационного метода для окисления фенолов, цианидов, некоторых СПАВ. На рис. 6.23 приведены графики, характеризующие процесс очистки радиолизом сточной воды производства синтетического каучука, загрязненной некалем (смесью анионных ПАВ). Из графиков следует, что скорость процесса изменялась до достижения 65–75 % эффекта очистки, а потом несколько замедлялась. По мере насыщения воды продуктами радиолиза наблюдалось снижение рН воды. |
Условия очистки существенно улучшаются, если производить перемешивание воды для выравнивания во всем объеме концентрации свободных радикалов. С этой целью полезен барботаж воздухом. Барботаж одновременно повышает содержание в воде кислорода, а это способствует увеличению скорости реакции.
Скорость окисления, как всегда, возрастает при избытке окислителей. Поэтому, с увеличением дозы радиации и, соответственно, количества образующихся свободных радикалов, необходимая продолжительность процесса сокращается.
6.3.3. Восстановители и процессы восстановления
Восстановление, т.е. процесс поглощения атомами вещества электронов, возможно только в присутствии их источников. Донорами электронов являются вещества, способные окисляться.
6.3.3.1. Восстановление соединениями серы
Соединения серы легко окисляются и поэтому являются хорошими восстановителями. Наиболее часто для восстановления используют сульфат Na2SO3, гидросульфит NaHSO3, бисульфит натрия Na2S2O5 и двуокись серы SO2. В этих веществах сера находится в четырехвалентном состоянии и при использовании в качестве восстановителя окисляется до шестивалентной. Указанные реагенты легко растворяются в воде и применяются в виде растворов.
Бисульфит предварительно разлагается при температуре + 70 °С до сульфата и двуокиси серы: Na2S2O5 = Na2SO3+SO2.
Рассмотрим условия восстановления шестивалентного хрома гидросульфитом натрия. Технология обезвреживания Сr6+ предусматривает его восстановление до трехвалентного с последующим образованием малорастворимого гидроксида Cr(OH)3, удаляемого из воды осаждением.
Реакция восстановления проходит в кислой среде:
Cr2O72– + 3HSO3– + 5H+ ↔ 2Cr3+ + 3SO42– + 4H2O.
Значение Е0 реакций восстановления Сr6+ равно + 1,36 [В], окисления серы + 0,29 [В]. Таким образом, реакция восстановления хромовой кислоты H2Cr2O7 осуществляется при потенциале 1,36 – 0,29 = 1,07 В > 0, т.е. проходит самопроизвольно и с большой интенсивностью.
Воду подкисляют, как правило, серной кислотой. Кинетика процесса восстановления зависит от двух главных факторов: рН воды и отношения активностей вводимого восстановителя и шестивалентного хрома в исходной воде.
Чаще всего процесс ведут при рН = 2 – 4. Влияние рН на продолжительность процесса и на его полноту иллюстрируется экспериментальными данными, приводимыми ниже. Начальная концентрация Сr6+ в исходной воде составляла 15 мг/л, температура воды +20 °С.
|
рН |
Продолжительность, мин |
|||
|
15 |
20 |
40 |
60 |
|
|
2,8 |
0,2 |
0,1 |
0,1 |
0 |
|
3,7 |
1,0 |
0,5 |
0,3 |
0,2 |
|
4,4 |
12,0 |
6,0 |
1,0 |
0,8 |
Можно констатировать, что даже незначительное повышение рН, вполне возможное по условиям дозирования, заметно сказывается на результатах процесса. В работе [18] отмечается, что полное восстановление хрома не происходит, если рН превышает 4 – 5; в этих условиях восстановитель полностью не используется и остается в воде.
Стехиометрические дозы восстановителей недостаточны для полного восстановления шестивалентного хрома в течение технически допустимой продолжительности процесса (5–15 минут) и увеличение скорости реакций требует применения избыточных доз реагентов.
Полученная стехиометрическим расчетом удельная доза 100 % гидросульфита натрия составляет 3,1 мг/мг шестивалентного хрома. Опыты показали, что при продолжительности реакции 5 минут и исходной концентрации шестивалентного хрома до 400 мг/л полное восстановление достигалось при дозах реагентов, на 70 % превышающих расчетные. При этом, в растворе оставался избыток введенного гидросульфита.
Чем ниже концентрация шестивалентного хрома в исходной воде, тем большим должен быть избыток восстановителя.
Восстановление пятивалентного мышьяка в трехвалентный с применением бисульфата натрия рассмотрено в [17]. Технология очистки стока от мышьяка включала: его восстановление, насыщение воды хлористым водородом для образования NaCl, удаления поваренной соли и, наконец, экстракцию оставшейся части мышьяка бензолом.
Предварительно сточная вода подкислялась, в нее вводился бисульфит натрия, и производился подогрев до + 70 °С. Было установлено, что при концентрации Аs5+ в исходной воде 466 мг/л и при удельной дозе 100 % бисульфита 42 мг/мг, восстанавливалось 87,5– 99 % мышьяка за 1–20 минут соответственно. После восстановления воду аэрировали для удаления избытка двуокиси серы.
Метод восстановления соединениями серы применяется при обескислороживании воды для подпитки котлов высокого давления. Кислород удаляется с целью защиты конструкций котлов, экономайзеров и трубопроводов от коррозии. Основную часть кислорода предварительно удаляют десорбцией (см. главу 4), доочистка производится химическими методами.
В качестве восстановителя часто используют сульфит натрия. В результате реакции сульфит окисляется до сульфата, а валентность серы возрастает от четырех до шести:
2Na2SO3 + O2 = 2Na2SO4.
По стехиометрическому расчету удельный расход сульфита составляет около 8 г на 1 г кислорода; если вместо сульфита применять гидросульфит натрия, удельная доза реагента возрастет почти вдвое.
Как отмечается в [9] на процесс обескислороживания влияет ряд факторов:
– скорость реакции при температуре воды до + 20 °С прямо пропорциональна содержанию кислорода в пределах его концентраций от 3 до 12 мг/л;
– с дальнейшим повышением температуры скорость реакции резко увеличивается;
– оптимальные значения рН воды, при которых скорость восстановления оказывается наибольшей, от 5 до 8;
– катализаторами реакции служат соли металлов, главным образом, меди и кобальта.
Недостатком сульфита натрия как восстановителя является повышение солевого состава воды после обескислороживания; кроме того, при термическом разложении Na2SO4 возможно образование сероводорода или сернистого ангидрида [9].
6.3.3.2. Восстановление металлами
Металлы легко окисляются и являются донорами электронов. По степени окисляемости металлы располагаются в следующем ряду:
Li>K>Ba>Ca>Na>Mg>Al>Be>Mn>Zn> Fe>Cr >Co>Ni>Sn>Pb>
>Cu>Hg>Ag>Pt>Au.
Металлы, расположенные в ряду слева, восстанавливают металлы, находящиеся правее. Катион Н+ восстанавливается до атомного водорода всеми металлами, начиная от Рb и левее. Многие металлы образуют катионы в зависимости от степени окисления. При увеличении степени окисления могут быть получены дополнительные электроны, используемые в процессах восстановления.
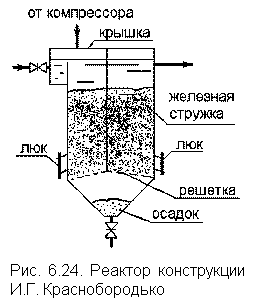 |
Например, двухвалентное железо восстанавливает шестивалентный хром, окисляясь до трехвалентного. Железо вводят в виде железного купороса. Восстановление шестивалентного хрома проходит по реакции:
2H2CrO4 + 6FeSO4 + 6H2SO4 = = Cr2(SO4)3 + 3Fe2 (SO4)3 + 8H2O.
Потенциал этой реакции, протекающей в кислой среде в присутствии серной кислоты, равен + 0,59 [В]. Чаще восстановление с применением двухвалентного железа осуществляется в реакторе, загруженном стальной стружкой (рис. 6.24). При контакте железа с серной кислотой происходит окисление Fe0 до Fe2+: Fe + H2SO4 = FeSO4 + H2↑.
|
Технологический процесс в реакторе включает: поступление загрязненной воды, обработанной серной кислотой до рН = 2–3, растворение железной стружки с образованием двухвалентного железа и выделением электронов, последующее окисление двухвалентного железа до трехвалентного с дополнительным выделением электронов. Генерация электронов и их поглощение восстанавливающимися примесями должны быть сбалансированы.
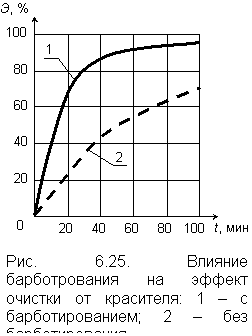 |
Процесс требует немедленного отведения продуктов восстановления и растворенного железа от поверхности железной стружки; в противном случае будет происходить блокирование части поверхности растворения. Деблокирование достигается барботажем воздуха через слой стружки. Влияние барботажа на результаты работы реактора иллюстрируются графиком на рис. 6.25. Эффект очистки воды от красителя при отсутствии барботажа оказался значительно ниже. Барботаж позволяет достичь максимального эффекта очистки (более 90 %) за 60 минут пребывания воды в реакторе; при отсутствии барботажа за этот же период эффект очистки составил около 50 %. Атомарный водород, окисляясь до Н+, участвует в восстановление многих видов водных загрязнений. По этой схеме осуществляется деструкция тетраэтилсвинца (ТЭС). При рН = 4,5 и при начальной концентрации ТЭС около 95 мг/л полное разрушение достигалось в течение 1,5 часов в соответствии с реакцией: Рb(С2Н5)4 + 2Н = Рb + 4С2Н6. В первой стадии восстановления (через 15–20 минут) ТЭС разрушался до триэтил-, затем до диэтилсвинца, и, наконец, до конечного продукта [17]. |
В работе [18] рассмотрен процесс разрушения красителей под действием атомарного водорода.
В состав красителей входят азо– и нитросоединения, которые хотя не подвергаются химическому окислению, но при восстановлении с участием атомарного водорода переводятся в нестойкие и относительно легко окисляющиеся аминосоединения. Схема процесса имеет вид:
![]() .
.
В щелочной среде аминосоединения могут быть затем окислены до СО2, NH2, Н2О и до некоторых нерастворимых соединений, образующих грубодисперсные примеси.




