6.3.2. Окислители и процессы окисления
6.3.2. Окислители и процессы окисления
К сильным окислителям относятся фтор, кислород, хлор и другие вещества, обладающие большими значениями окислительно-восстановительного потенциала Е. Вещества с промежуточной степенью окисления в зависимости от обстоятельств могут выступать и в роли окислителей, и в роли восстановителей. Напомним, что под степенью окисления понимается кажущийся заряд атомов, возникающий при отдаче или при присоединении электронов в окислительно-восстановительном процессе.
6.3.2.1. Хлорирование
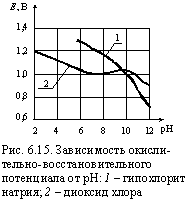
Хлор – сильный окислитель. Обладая большой реакционной способностью, он легко взаимодействует с элементами, отдающими электроны. С кислородом хлор образует несколько соединений, в которых проявляет положительную валентность. Эти соединения (диоксид хлора, хлорноватистая кислота, гипохлорит-ион) неустойчивы и являются эффективными окислителями. Окислительно-восстановительные потенциалы различных форм хлора зависят от рН воды и, как это видно из рис. 6.15 с увеличением водородного показателя уменьшаются. Активный хлор в зависимости от значения рН воды может находиться в трех формах (рис. 6.16). Молекулярный хлор находится в воде при рН ≤ 2, в интервале рН от 2 до 5 он содержится одновременно с хлорноватистой кислотой НОСl, до рН ≤ 10 присутствуют хлорноватистая кислота и гипохлорит-ион, более 10 – только гипохлорит-ион СIO–. Л.А. Кульский отмечал двойственность хлора, которая заключается в том, что он может выступать в качестве хлорирующего агента, участвующего в реакциях замещения, и в качестве окислителя. Первое свойство доминирует у активного хлора в форме Cl2. В результате реакций замещения, характерных для процессов хлорирования органических веществ, образуются хлорорганические соединения, обычно обладающие токсичностью и рассматриваемые как водные загрязнения. К ним, в частности, относятся тригалогенметаны (хлороформ, четыреххлористый углерод, трихлорэтан и тетрахлорэтилен) – продукты, образующиеся при обесцвечивании цветных вод поверхностных источников хлорированием.
 |
Хлорноватистая кислота легко разлагается по двум «маршрутам»: по хлоридному и кислородному. В первом случае образуется малоактивный хлорат–анион СlО3– и соляная кислота:
3НСlО ↔ НСlO3+2HCl.
Во втором случае помимо соляной кислоты выделяется кислород: 2HСlO ↔ 2HCl + O2. Образование соляной кислоты при разложении НОСl приводит к понижению рН. |
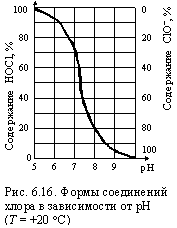 |
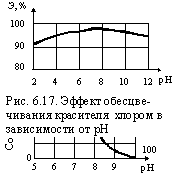
Во избежание вызываемого этим самоторможения процесса, хлорирование рекомендуется производить при рН ³ 7, хотя окислительная способность гипохлорит-иона ниже, чем у хлорноватистой кислоты. На рис. 6.17 приводится экспериментальный график, иллюстрирующий эффект обесцвечивания красителя при хлорировании в зависимости от рН. Максимальный эффект достигался при рН = 6,5 – 7,5. На выбор формы активного хлора влияют свойства окисляемого вещества, образующихся при хлорировании промежуточных и конечного продуктов. Например, при окислении фенолов желательно, чтобы они были диссоциированы; в таком состоянии они находятся при рН ≥ 7,5. Оптимальными считаются значения рН = 7,5 – 8,5. Как следует из рис. 6.16, в этом случае более 50 % хлора находятся в форме гипохлорит-иона.
|
 |
Рассмотрим соображения по назначению рН при окислении хлорированием цианида СN–, являющегося крайне токсичным ионом. Хлорирование в кислой среде, приводит к образованию еще более токсичного хлорциана: CN– + Cl2 ↔ ClCN + Cl–. В щелочной среде при рН = 9 – 12, т.е. с участием главным образом гипохлорит–иона, цианид окисляется до малотоксичного цианата СNО–. Цианаты способны гидролизоваться по схеме: CNO– + 2H2O ↔ NH4+ + CO32–. |
В щелочной среде обезвреживаются и комплексные цианиды металлов: меди, цинка, кадмия и других. Реакция окисления проходит по схеме:
[Me(CN4)]2– + 4OCl– + 2H2O ↔ 4CNO– + 4Cl– + Me(OH)2,
где Ме – обозначение металла; реакция условно записана для двухвалентного металла.
Обезвреживание цианидов эффективно при хлорировании диоксидом хлора в щелочной среде (рН = 10 – 11):
2CN– + ClO2 + 2OH– ↔ 2CNO– + ClO– + H2O.
Деструкция хлорированием соединений с ковалентными связями (некоторые СПАВ, красители и другие) достигается при участии катализаторов – металлов с переменной валентностью. Например, совместное применение хлора и небольших доз перманганата калия позволяет достичь эффективной дезодорации (устранения запахов) из поверхностных источников. В этом случае роль катализаторов выполняют соли марганца, валентность которых может меняться от семи до двух.
Как отмечал профессор И.Г. Краснобородько, катализатор необходим для образования промежуточного активированного комплекса, который обеспечивает перераспределение энергии химических связей в молекулах хлорноватистой кислоты и гипохлорит-иона, одновременно присутствующих в воде:
K + HClO + ClO– → ![]() → ClO· + ClO· + H+ + K,
→ ClO· + ClO· + H+ + K,
где К – обозначение катализатора.
После распада комплекса и выхода из него катализатора взамен исходных форм активного хлора (НОСl, ClO–) появляются реакционноактивные радикалы, которые участвуют в реакции образования наиболее сильного окислителя, атомарного кислорода. Реакция проходит в щелочной среде:
ClO· + ClO· + OH– → 2O + 2Cl– + OH·.
Гидроксид-радикал OH·, потенциал которого +2,8 [23], взаимодействует с окисляемым веществом, образуя с ним продукты, не являющиеся загрязнениями.
Теоретически необходимая доза активного хлора определяется простыми стехиометрическими расчетами.
Пример 6.4. Определить дозу хлорной извести, содержащей 30 % активного хлора, необходимую для обезвреживания цианида меди, концентрация которого составляет 50 мг/л.
Решение.
1. Реакция окисления проходит по схеме:
[Cu(CN)3]2– + 3Cl2 + 8OH– ↔ 3CNO– + 6Cl– + 3H2O + Cu(OH)2.
Отсюда, удельная доза активного хлора, мг/мг цианида равна 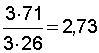 , где молекулярная масса Сl2 равна 71,0, то же цианида 12+14=26.
, где молекулярная масса Сl2 равна 71,0, то же цианида 12+14=26.
2. Относительное содержание цианида в комплексном соединении 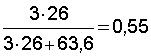 , где 63,6 –молекулярная масса меди.
, где 63,6 –молекулярная масса меди.
3. Расчетная доза хлорной извести: 50∙0,55∙(100/35)=91,7 мг/л.
Дозы хлора, определяемые стехиометрическими расчетами, недостаточны для полного разрушения устойчивых загрязнений в течение периода времени допустимой продолжительности. В результате, после очистки вода оказывается загрязненной промежуточными продуктами деструкции. Например, при хлорировании фенолосодержащих вод расчетными дозами хлора вместо конечного продукта (угольной кислоты) в воде обнаруживаются моно-, ди- и трихлорфенолы, обладающие неприятным запахом. В литературе содержатся рекомендации по назначению оптимальных доз активного хлора, обеспечивающих эффективную очистку. Рекомендуемый избыток хлора (10–30 % и более) назначается в зависимости от способности того или другого вещества к окислению. Если в воде одновременно содержатся различные примеси, окисляющиеся хлором, дозы хлора, необходимые для их окисления, суммируются.
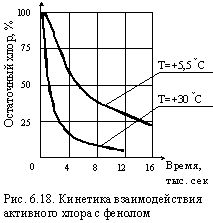 |
Продолжительность контакта загрязнений с хлором зависит от вида примеси, ее концентрации, рН воды, ее температуры. На рис. 6.18 приводится график, описывающий кинетику окисления фенола хлором при некоторых постоянных условиях эксперимента. Повышение температуры воды с + 5,5 до 30 оС позволило использовать для окисления практически весь введенный хлор через 8000–12000 с; при более низкой температуре и за ту же продолжительность времени было использовано всего 65–75 % хлора. Заметим, что расчетная продолжительность процесса окисления хлорированием принимается равной продолжительности окисления той примеси, которая имеет наименьшую реактивную способность. |
Применение хлора как окислителя имеет ряд недостатков: образование опасных продуктов прямого хлорирования (хлорфенолы, хлорциан, хлорамины), необходимость в избыточных дозах хлора при глубоком окислении, что требует последующего дехлорирования, опасность работы с хлором, являющимся токсическим веществом.
В [5] использование хлора преимущественно рекомендуется в случаях, когда его дозы невелики.
6.3.2.2. Окисление кислородом
Кислород – один из наиболее сильных окислителей. При восстановлении он образует двухвалентный анион; положительную валентность кислород ни в каких условиях не проявляет. Это объясняется весьма малыми размерами атома кислорода, вследствие чего электроны прочно связаны с ядром.
Окислительно-восстановительный потенциал кислорода зависит от рН воды и уменьшается с увеличением этого показателя:
Е = Е0 – 0,058рН.
В технологии очистки используется молекулярный кислород, содержащийся в воздухе или выделяющийся при разложении некоторых кислородосодержащих веществ, а также озон, являющийся аллотропической модификацией кислорода.
Применение кислорода воздуха. Известно, что в воздухе по массе содержится 23 % кислорода. Растворимость кислорода ограничена парциальным давлением и температурой.
Введение кислорода воздуха (аэрация) достигается путем разбрызгивания воды, эжекцией, барботированием и другими приемами. Окислительную способность системы аэрации, зависящую от диффузии, можно определить по уравнению [8]:
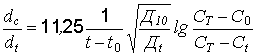 , (6.10)
, (6.10)
где ![]() – окислительная способность (скорость насыщения кислородом), г/м3ч; t0; t – моменты времени в начале и в конце аэрации, ч; Д10;
– окислительная способность (скорость насыщения кислородом), г/м3ч; t0; t – моменты времени в начале и в конце аэрации, ч; Д10;
Дt – коэффициенты диффузии кислорода при температурах 10 °С и Т °С; 11,25 – содержание кислорода при полном насыщении, атмосферном давлении и температуре +10 °С, г/м3; CT – то же при температуре 1 °С, г/м3; C0, Ct – фактическое содержание кислорода в момент времени t0 и t.
Механизм окисления кислородом воздуха часто включает несколько последовательных ступеней с образованием химически активных кислородосодержащих радикалов. Рассмотрим в качестве примера окисление двухвалентного железа в трехвалентное.
Уравнение реакции имеет вид:
4Fe2+ + O2 + 2H2O ↔ 4Fe3++4OH–.
В [10] эта реакция представляется поэтапно следующим образом:
1. Fe2+ + O2 ↔ Fe3+ + O2– ;
2. O2– + H+ ↔ HO2· (свободный радикал);
3. Fe2+ + HO2· ↔ Fe3+ + HO2–;
4. НО2– + Н+ ↔ Н2О2 (пероксид водорода);
5. Fe2+ + H2O2 ↔ Fe3+ + OH– + OH· (свободный радикал);
6. Fe2+ + OH· ↔ Fe3+ + OH–;
7. 2Н2О ↔ 2Н+ + 2ОН–.
Таким образом процесс окисления двухвалентного железа молекулярным кислородом включает образование дополнительных окислителей (свободных радикалов НО2· и ОН·, а также пероксида водорода). Процесс поддерживается за счет диссоциации молекул воды, что позволяет обеспечить его необходимыми ионами Н+ и ОН–.
Окисление двухвалентного железа в трехвалентное происходит при значении rН2 не менее 18–19. По исследованиям Г.Ю. Асса [9] необходимый для реакции равновесного окисления потенциал Е0 ≥ 1,34–0,177рН.
Константа скорости реакции остается постоянной при условии, что концентрация Fe2+, температура воды и рН не меняются и, согласно формуле (6.4):
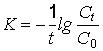 ,
,
где С0 и Сt – концентрация двухвалентного железа в начале и в конце процесса окисления, t – продолжительность процесса.
Особенно влияет на константу скорости рН воды. Как показали исследования, скорость реакции окисления двухвалентного железа в трехвалентное при рН = 8 в 41 раз больше, чем при рН = 7,2, и в 5424 раза больше, чем при рН = 6,0, а при рН < 4,9 окисление прекращается.
По стехиометрическому расчету на окисление 1 г двухвалентного железа затрачивается 0,143 г кислорода.
Если реакция воды нейтральная или слабокислая, давление атмосферное, а температура 10–15 °С, то содержание кислорода в воде около 10 мг/л, т.е. вполне достаточное для окисления двухвалентного железа в значительных концентрациях, и необходимость в интенсификации процесса отсутствует. Более того, при повышении температуры и рН константа скорости реакции может настолько увеличиться, что сдерживающим фактором станет диффундирование кислорода в реакционную область.
Окисление активизируется на границе двух фаз: воды и твердых поверхностей. Нерастворимые продукты окисления, отлагающиеся на поверхности твердых ГДП (например, окислы железа или марганца), играют роль катализаторов процесса.
Эти оптимизирующие условия реализованы в технологической схеме обезжелезивания упрощенной аэрацией.
На окисление кислородом устойчивых загрязнений отрицательно сказывается его недостаточная концентрация в воде при атмосферном давлении. Процесс может быть интенсифицирован аккумуляцией кислорода сорбентами, катализаторами, увеличением концентрации при растворении под высоким давлением, а также оптимизацией температуры и рН воды.
А.Д. Смирнов отмечал, что окисление кислородом воздуха на активированных углях, в которых кислород аккумулируется, также эффективно, как озонирование. Отмечено каталитическое воздействие озона, усиливающее окислительные свойства кислорода. Вероятно, такими свойствами обладают продукты многоэтапного распада озона в воде (НО3, НО2, НО), даже при их незначительной концентрации. Эффективность применения кислорода воздуха значительно повышается в присутствии металлокомплексных катализаторов. Металлокомплексный катализ позволяет очистить воду от трудноудаляемых примесей, таких как сульфиды или нефтепродукты.
Искусственно изготовляемые катализаторы содержат размещенные на носителях (подложках) активные центры: ионы нескольких переходных металлов, связанные в комплексы молекулой кислорода (Fe3O4, Mn3O4, MnFe2O4 и другие).
Свободное перемещение в металлах электронов позволяет повысить активность сорбирующихся на фракциях катализатора молекул растворенного кислорода и загрязнителей, а часть кислорода переводить в формы свободных радикалов.
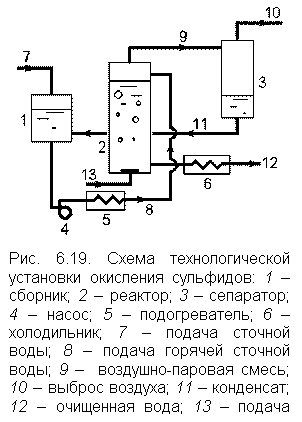 |
Глубокая деструкция достигается и в случае применения жидкофазного метода, когда кислород воздуха растворяется под высоким давлением при высоких температурах. На рис 6.19. приведена такая технологическая схема окисления сульфидов. Сульфидами называются соединения серы с металлами и некоторыми неметаллами. К сульфидам относятся, в частности, сероводород, метилмеркоптан, гидросульфиды и другие примеси, присутствующие в серосодержащих сточных водах предприятий нефтеперерабатывающей и нефтехимической промышленности. Сточная вода, содержащая сульфиды, подогревается до температуры 100–120 °С и барботируется воздухом в напорном реакторе типа колонны под давлением 0,8–1,0 МПа. В качестве катализатора применяются графитовые материалы [5]. Окисление сульфидов по схеме на рис. 6.19, т.е. в условиях интенсификации процесса, продолжается несколько минут с образованием сульфатов [11]. В [12] рассмотрена технология обезвреживания жидкофазным окислением серосодержащих стоков предприятий целлюлозно–бумажной промышленности. Воздух под давлением 1,0–1,2 МПа смешивается с водой, подогретой до температуры 80–85 °С и имеющей щелочную реакцию. Продолжительность окисления составляет 8–10 минут. Полностью окисляются: сероводород до сульфата натрия и тиосульфата, метилмеркаптан – до менее опасной метансульфокислоты, частично окисляются скипидар и метиловый спирт. |
При контакте воды с чистым кислородом, т.е. при условии, когда его парциальное давление равно полному давлению газа, растворимость увеличивается почти в пять раз. Например, при атмосферном давлении и температуре воды + 20 °С растворимость кислорода воздуха составляет 8,84 мг/л, а чистого кислорода 44 мг/л, для температуры + 15 °С – 9,76 мг/л и 48,0 мг/л, соответственно.
6.3.2.3. Окисление пероксидом водорода
Пероксид водорода Н2О2 имеет высокий окислительно-восстановительный потенциал, нормальное значение которого в реакции 2Н2О ↔ Н2О2 + 2Н+ + 2е– равно + 1,77 В. При разложении пероксида образуется кислород и выделяется тепло:
2Н2О2 = 2Н2О + О2 + 98,8 кДж/моль.
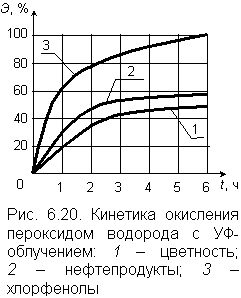 |
В условиях химической или физической активации разложение пероксида сопровождается образованием свободных радикалов ОН· и О·, обладающих, как уже отмечалось, чрезвычайно высокой реакционной способностью. В роли катализаторов выступают металлы с переменной валентностью: марганец, медь, железо, кобальт. На рис. 6.20 приведен график, описывающий кинетику окисления фенола пероксидом водорода в присутствии катализатора – двухвалентного железа FeSO4. Окисление продолжается 10–20 минут. За несколько десятков минут в присутствии металлов–катализаторов и в кислой среде полностью (до состояния карбоновой кислоты) разрушаются нитриды, до цианатов – цианиды, органика бытовых сточных вод при рН = 5 на 60 % окисляется до углекислого газа. Сильнейшую активизацию процесса окисления вызывает фотолиз (ультрафиолетовое облучение) в интервале значений рН от 6,5 до 8,0. В этих условиях происходит разложение пероксида водорода и образование свободных радикалов НО·: |
Н2О2 ![]() 2НО·.
2НО·.
Свободные радикалы способны разрушить многие устойчивые соединения. Рассмотрим это на примере окисления предельных углеводородов.
Предельными углеводородами или алканами, к которым относятся метан, этан, пропан и другие, называются соединения, состоящие из атомов углерода и водорода.
Атомы имеют ковалентные связи С–С и С–Н. При разрушении молекулы алкана по связи С–Н образуется углеродный радикал RС и атом водорода. Например, СН4 (метан) распадается на радикал СН3 (метил) и водород.
Окисление предельных углеводородов свободными радикалами НО· происходит согласно следующим уравнениям реакций:
RСH + HO· ↔ RС + H2O;
RС + O2 ↔ RСOO·;
RСOO· + RСH ↔ RСOOH + RС;
2RСOOH ↔ RСН + RСOO· и т.д.
По японским исследованиям сочетание пероксида водорода с фотолизом позволяет разрушить гуминовые кислоты до углекислого газа и воды, достичь глубокой деструкции СПАВ, нефтепродуктов, пестицидов и ряда других примесей техногенного происхождения. Достигаемый при этом эффект очистки достаточно высок, как это видно из экспериментальных графиков на рис. 6.20. Исследования были выполнены для воды, содержащей 1,5 мг/л нефтепродуктов, 2,1 мг/л хлорфенола, имеющей цветность 90 градусов. После очистки в воде не содержалось токсичных продуктов окисления. Следует заметить, что при использовании пероксида водорода вообще теоретически невозможно образование продуктов более токсичных, чем исходные органические соединения [13].
Применение перекиси водорода имеет то несомненное преимущество, что это наиболее чистый в экологическом отношении способ окисления. В [53] отмечается, что до 25 % производимого в мире пероксида водорода идет на цели охраны окружающей среды.
В табл. 6.5 приводятся некоторые данные о применении пероксида водорода для деструкции различных соединений.
Таблица 6.5
Примеры деструктивных процессов с участием пероксида водорода [53]
|
Соединение |
Уравнение реакции |
Удельная доза Н2О2, г/г |
рН среды |
|
Серосодержащие |
|||
|
Сероводород |
H2S + H2O2 → 2H2O + S· |
1 |
6–8 |
|
Гидросульфиды |
HS– + H2O2 + H+ → 2H2O + S· |
1,03 |
£ 8 |
|
Сульфиды |
S2– + 4H2O2 → SO42– + 4H2O |
4,25 |
> 8 |
|
Меркаптаны и другие тиолсодержащие соединения (RSH) |
RSH + 3H2O2 + OH– → RSO3– + 4H2O (2RSH + H2O2 → RSSR + 2H2O)
|
> 5 |
2–11 |
|
Сульфиты |
SO32– + H2O2 → SO42– + H2O |
0,43 |
> 8 |
|
Диалкилсульфиды (RSR) |
RSR + H2O2 → RSO + H2O |
> 2 |
2–4 |
|
Диалкилдисульфиды (RSSR) |
RSSR + 5H2O2 + 2OH– → 2RSO3 + 6H2O |
> 5 |
2–11 |
|
Полисульфиды (SX2–) |
S42– + 13H2O2 + 6OH– → 4SO42– + 16H2O S52– + 16H2O2 + 8OH– → 5SO42– + 20H2O |
3,45 3,4 |
> 8 > 8 |
|
Дитиониты |
S2O42– + 3H2O2 + 2OH– → 2SO42– + 4H2O |
0,8 |
> 8 |
|
Тиосульфаты |
S2O32– + 4H2O2 + 2OH– → 2SO42– + 5H2O |
1,21 |
> 8 |
|
Диоксид серы |
SO2 + H2O2 → H2SO4 |
0,53 |
< 6 |
|
Азот- и хлорсодержащие |
|||
|
Цианиды простые |
CN– + H2O2 → CNO– + H2O (окисление) CNO– + H2O + H+ → CO2 + NH3 (гидролиз цианатов) |
1,31 |
8,5–10 |
|
Цианиды комплексные |
2[Cu(CN)3]2– + 7H2O2 + 2OH– → → 2[Cu(OH)2]↓ + 6CNO– +6H2O |
1,52 |
9–11 |
|
Нитриты |
NO2– + H2O2 → NO3– + H2O |
0,74 |
2–5 |
|
Оксиды азота |
NO + NO2 + 2H2O2 → 2HNO3 + H2O 2NO2 + H2O2 → 2HNO3 |
0,89 0,37 |
³ 10 ³ 10 |
|
Хлор |
Cl2 + H2O2 → O2 + 2HCl |
0,48 |
7–9 |
|
Гипохлориты |
OCl2 + H2O2 → O2 + Cl– + H2O |
0,66 |
7–9 |
|
Содержащие тяжелые металлы |
|||
|
Перманганаты |
2MnO4– + 5H2O2 + 6H+ → → 2Mn2+ + 5O2 + 8H2O |
0,71 |
< 3,5 |
|
Хроматы |
2CrO42– + 3H2O2 + 10H+ → → 2Cr3+ + 3O2 + 8H2O |
0,44 |
< 3,5 |
|
Соли железа |
Fe2+ + H2O2 + 2H+ → Fe3+ + 2H2O |
0,3 |
< 3,5 |
|
Органосодержащие |
|||
|
Формальдегид |
CH2O + 2H2O2 → CO2 + 3H2O |
2,27 |
£ 9 |
|
Гидрохинон |
C6H6O2 + 13H2O2 → 6CO2 + 16H2O |
4,02 |
4–6 |
|
Фенол |
C6H6OH + 14,5H2O2 → 6CO2 + 18H2O |
5,06 |
3–4 |
Примечание: R – радикал
Свободные радикалы образуются на промежуточных этапах многих реакций окисления с участием пероксида водорода. Это видно, например, из записи многоэтапной реакции окисления двухвалентного железа кислородом воздуха, на четвертом этапе которого образуется пероксид водорода, а на пятом он взаимодействует с катионом двухвалентного железа. Реактив фентона, состоящий из Н2О2 и Fe2+, служит источником получения свободных радикалов и используется для этой цели при органическом синтезе. Разложение пероксида водорода с образованием свободного радикала происходит в присутствии ионов серебра. Пероксид водорода широко используется для очистки промышленных сточных вод предприятий нефтяной, нефтеперерабатывающей, нефтехимической, лесотехнической промышленности, при производстве бумаги и целлюлозы, строительных материалов, текстиля и других.
Преимущества пероксида водорода сравнительно с другими окислителями заключается в большей стабильности, простоте аппаратуры, необходимой для обработки воды, избирательным действием по отношению к окисляющимся примесям воды, в пределах которого может применяться этот реагент. Однако, главным преимуществом пероксида водорода является экологическая чистота процесса, о чем упомянуто выше.
Заметим, что в ряде реакций пероксид водорода выступает в качестве восстановителя, а не окислителя. В табл. 6.5 приводятся характерные реакции с участием пероксида водорода при очистке окислением и восстановлением, стехиометрически рассчитанные дозы реагента, рекомендуемые значения рН. Следует иметь в виду, что дозы должны определяться опытным путем, т.к. зависят от конкретных условий прохождения реакции. Окисление перксидом водорода интенсифицируется в присутствии металлов с переменной валентностью и их окислов (марганец, никель, медь и др.). Как будет показано ниже, пероксид водорода может применяться в сочетании с озонированием.
Как будет показано ниже, пероксид водорода может применяться в сочетании с озонированием.




