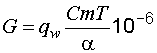6.2.2. Корректировка рН при коагуляции природных вод кислым коагулянтом
6.2.2. Корректировка рН при коагуляции природных вод кислым коагулянтом
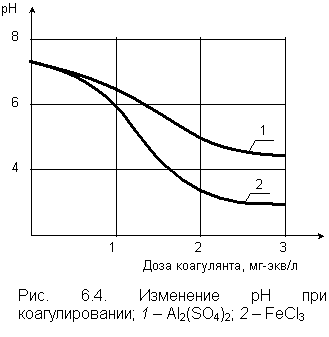 |
Коагулянты (сульфаты или хлориды алюминия и железа) являются солями сильных кислот (серная, соляная) и слабых оснований. Гидролиз этих солей сопровождается выделением катионов водорода и понижением рН воды. Константа гидролиза и рН связаны зависимостью: рН = 7– рК + lgС, где рК – отрицательный логарифм константы гидролиза, С – концентрация соли. На рис. 6.4 приведен график, показывающий изменение рН воды в зависимости от дозы коагулянта. При больших дозах рН резко уменьшается, и воду необходимо подщелачивать. При коагуляции воды катионы водорода взаимодействуют с гидрокарбонат-ионами НСО3– и образуют слабую плохо диссоциирующую угольную кислоту. Если буферность воды недостаточна и катионы водорода не будут связываться в недиссоцируемые соединения, то гидролиз прекратится. Как известно, в результате коагуляции формируются хлопья гидроксидов железа и алюминия. Разумеется, они не должны растворяться в воде, что зависит от значений водородного показателя. Гидроксид железа практически нерастворим при рН > 4,1. Гидроксид алюминия обладает амфотерными свойствами и растворяется как в кислой, так и в щелочной среде; минимум растворимости Al(OH)3 при рН = 5.2. |
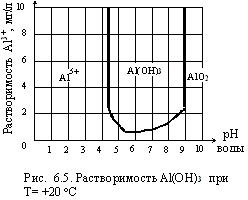 |
Растворимость гидроксида алюминия в кислой среде зависит от концентрации катионов водорода в третьей степени, а в щелочной – от концентрации анионов ОН– в первой степени. Это определяет несимметричную форму графика растворения Al(OH)3, приведенного на рис. 6.5. Гидроксид алюминия образуется при рН ~ 7,5. При меньших значениях водородного показателя наряду с гидроксидом в воде присутствуют труднорастворимые основные соли алюминия AlOHSO4 и Al2(OH)4SO4, обладающие хорошей адсорбционной способностью. Максимальное количество этих солей наблюдается при рН ≤ 6,5 [3]. |
Обычно, при коагуляции сернокислым алюминием мягких, маломутных и цветных вод принимают рН = 6,5; воды средней мутности, цветности и жесткости – около 7; при обработке жестких, мутных и малоцветных вод – до 7,5. Повышение в последнем случае рН объясняется тем, что AlO2– взаимодействует с катионами кальция и образует с ними плохо растворимые соединения. Поддержание рН воды на оптимальном уровне снижает растворимость Al(OH)3 и позволяет уменьшить концентрации алюминия в питьевой воде (ПДК = 0,5 мг/л).
6.2.3. Корректировка рН для изменения формы загрязняющих примесей
Как отмечалось, слабые кислоты и основания плохо диссоциируются, и условия их диссоциации зависят от рН воды. Если принять, что концентрация диссоциированных молекул не должна превысит 0,1% от их количества (отрицательный логарифм этого значения равен +3), то для исключения диссоциации слабых кислот рН≤рКдис.–3, а слабых щелочей рН ³ рКдис+3.
Многие вещества, называемые протолитами, способны поглощать или отдавать протоны Н+, выполняя при этом роли оснований и кислот. Изменяя рН воды можно направлять такие процессы в нужном направлении и получать продукты в удобных для дальнейшей очистки формах (молекулы, ионы, газы).
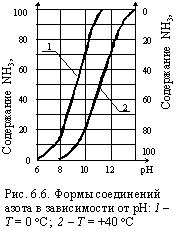 |
Приведем несколько примеров корректировки рН. Удаление NH+4 и аммиака. При растворении в воде аммиака образуется гидрат окиси аммония, который гидролизуется:
NH3 + H2O
Как следует из рис. 6.6 соотношение концентраций аммиака и катиона NH4+ обусловлены значениями рН воды. В ряде случаев очистка от этих соединений наиболее просто осуществляется методом десорбции, для чего воду следует подщелачивать до рН > 10,5 – 11,0 и переводить азот в форму газа NH3. Нередко, очистка воды от соединений азота производится ионным обменом. Обычно, для этого применяют цеолиты, являющиеся природными катионитами. При ионном обмене воду подкисляют и переводят азот в форму NH4+. |
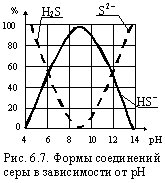 |
Удаление сероводорода. Сероводород H2S в воде диссоциируется с образованием гидросульфида НS– и сульфид-иона S2– (рис. 6.7). При рН £ 5 в воде находится только сероводород, при рН = 7 – половина соединений находится в форме сероводорода, а половина – в форме гидросульфида и т.д. Наиболее просто из воды удаляется сероводород (например, десорбцией), для чего воду подкисляют до рН ≤ 5 либо сильной кислотой, либо продувкой дымовыми газами, содержащими СО2 (рекарбонизация). Стабилизация воды. В природных водах в зависимости от рН и температуры углекислота может находиться в форме углекислого газа, бикарбонатных анионов НСО3–, карбонатных анионов СО32– (рис. 6.8). Как следует из графика, при рН ≤ 8.4 углекислота находится в виде СО2 и НСО3–, что соответствует первой ступени диссоциации двухосновной угольной кислоты: Н2СО3 D Н+ + НСО3–. |
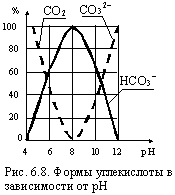 |
Каждому значению содержания НСО3– соответствует равновесное содержание СО2. На этом этапе диссоциации щелочность воды практически равна содержанию бикарбоната. На второй ступени диссоциации в воде создается равновесное содержание НСО3– и СО32– в соответствии с уравнением НСО3– D Н++СО32–, а щелочность практически равна суммарному содержанию бикарбоната и карбонат-иона. Вода считается стабильной, если в ней не растворяется карбонат кальция CaCO3, образующий на стенках труб защитную пленку, затрудняющую коррозию, и если не происходит его выделения на стенках труб. В случае, когда содержание в воде углекислого газа превышает равновесную концентрацию, вода нестабильна (агрессивна) и растворяет карбонат кальция: CaCO3 + CO2 + H2O |
Разность рН0 – рНs = J называется индексом насыщения, который в данном случае имеет отрицательное значение.
Если содержание углекислого газа в воде меньше равновесного, то произойдет распад бикарбонат-ионов 2НСО3 ![]() СО2 + СО32– + 2Н2О. Ионы СО32– взаимодействуют с катионами кальция и образуют труднорастворимый карбонат кальция: Са2+ + СО32– = СаСО3. В этом случае J > 0 и вода оказывается нестабильной. Ее стабилизация достигается подкислением, что приводит к снижению рН0 до нового равновесного значения рНs, а индекса насыщения до нуля.
СО2 + СО32– + 2Н2О. Ионы СО32– взаимодействуют с катионами кальция и образуют труднорастворимый карбонат кальция: Са2+ + СО32– = СаСО3. В этом случае J > 0 и вода оказывается нестабильной. Ее стабилизация достигается подкислением, что приводит к снижению рН0 до нового равновесного значения рНs, а индекса насыщения до нуля.
В литературе приведены методики расчета доз кислот и щелочей, необходимые для стабилизации воды с положительным и с отрицательным значениями индекса насыщения [4].
6.2.4. Установки для нейтрализации воды и корректировки рН
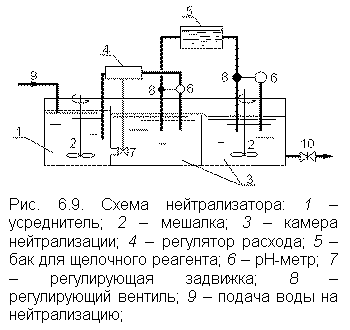 |
Схемы установок для нейтрализации воды и корректировки рН приведены на рис. 6.9–6.11. Установка по рис. 6.9 включает усреднитель и двухступенчатый реактор для грубой и тонкой дозировки нейтрализующего реагента. Дозирование осуществляется при постоянном контроле рН. Установка рассчитана на быстрое прохождение реакции нейтрализации и применение в качестве реагентов водных растворов сильных электролитов. На рис. 6.10 приведена схема нейтрализатора с сухим дозированием реагентов, которые вводятся в поток при помощи эжектора. Поскольку продолжительность нейтрализации может составить 15–20 минут и более, предусматривается камера реакции соответствующей вместимости и система перемешивания воды барботированием. На рис. 6.11 приводится схема нейтрализатора для подкисления воды рекарбонизацией (продувкой дымовыми газами). По такой схеме может стабилизироваться техническая вода, имеющая положительный индекс стабильности, например, оборотная вода охлаждения для теплообменной аппаратуры предприятий металлургической и химической промышленности. Следует заметить, что расход дымовых газов зависит от их |
состава, содержания в них СО2.
|
Рис. 6.10. Схема нейтрализатора с сухим дозированием реагента: 1 – подача воды; 2 – эжектор; 3 – подача сжатого воздуха; 4 – воздухораспределительная система; 5 – реактор; 6 – отвод воды после нейтрализации |
Рис. 6.11. Схема рекарбонизации воды: 1 – дымовая труба; 2 – воздуходувка; 3 – барбатер; 4 – подача воды; 5 – насос; 6 – подача воды после рекарбонизации |
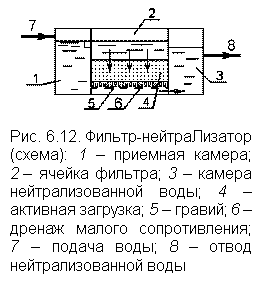 |
Для нейтрализации сильных кислот и для «связывания» агрессивной углекислоты применяются фильтры с активной зернистой загрузкой (рис. 6.12). В качестве загрузки используют известняк и мрамор СаСО3, полуобожженный доломит (магномасса) MgOCaCО3, искусственные материалы, включающие MgO и СаСО3 [5, 6]. Метод целесообразен в случае нейтрализации азотной и соляной кислоты, т.к. соответствующие соли MgCl2, СаСl2, Са(NO3)2, Мg(NO3)2 хорошо растворимы в воде. Если нейтрализуется вода, содержащая более 5–8 мг/л серной кислоты, есть опасность «гипсования» загрузки солью СаSO4. Исходным параметром, необходимым для расчета фильтров, является t – продолжительность контакта нейтрализуемой воды с активной загрузкой. Продолжительность зависит от состава водных примесей, содержания активных компонентов в материале загрузки, ее гранулометрического состава, требований к качеству фильтрата. |
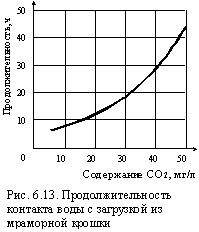 |
При нейтрализации сильных кислот продолжительность контакта обычно составляет 20–30 минут, для связывания углекислоты – до 30 минут и более, в зависимости от ее содержания в воде (рис. 6.13). По значению t определяют толщину слоя загрузки H = Vt, где V – скорость фильтрации, принимаемая до 50 м/ч и более. Потери загрузки, которая растворяется при использовании, равны:
|
где qw – расход воды, м3/ч; С – концентрация кислоты или углекислого газа, г/м3; m – удельная затрата реагента, г/г; a – содержание активного реагента в материале загрузки; Т – продолжительность цикла (до пополнения количества загрузки).
Значения m находятся расчетом и приводятся в табл. 6.3.
Пример 6.2. Определить потребность в известняке для нейтрализации азотной кислоты, если qw = 10 м3/ч, С = 500 г/м3, a = 0,5, Т = 100 ч, m = 0,795 г/г.
Решение.
![]() т.
т.
6.3. Деструкция примесей окислением и восстановлением
6.3.1.Общие сведения
Окислительно-восстановительный или редокс-процесс – один из основных способов разрушения водных загрязнений.
Окисление сопровождается отдачей, а восстановление – принятием электронов атомами или ионами. Вещества, отдающие электроны (доноры), окисляются и являются восстановителями веществ, принимающих электроны (акцепторов). Акцепторы электронов при этом восстанавливаются и выступают в роли окислителей по отношению к донорам. В химических окислительно-восстановительных реакциях необходимо одновременное присутствие и окислителей, и восстановителей.
Если вещества имеют ковалентные химические связи, то обмен электронами не происходит, но возникает их оттягивание, что приводит к ослаблению связей.
Химические реакции можно рассматривать как одно из проявлений массообмена.
Электронообмен между частицами окислителя и восстановителя возможен, если между ними существует разность потенциалов. Соответствующие напряжения определяют окислительно-восстановительный потенциал системы.
Значение окислительно-восстановительного потенциала указывает на принципиальную возможность тех или иных окислительно-восстановительных реакций, а также на их направленность (окисление либо восстановление того или ионного компонента, участвующего в реакции).
Величина потенциала измеряется рН-метром с платиновым и водородным электродом. В табл. 6.4 приведены значения потенциалов для равновесных условий, когда интенсивность прямой и обратной реакции (окисление и восстановление) одинакова. Эти «нормальные потенциалы» определены для температуры воды + 20 оС. За ноль принято значение потенциала реакции восстановления молекулярного водорода Н2 ↔ 2Н+ + 2е–.
Пример 6.3. Определить возможность окисления хлором, находящегося в воде сероводорода.
Решение.
Реакция окисления проходит по схеме: H2S+Cl2 = S↓+2HCl.
Как следует из табл. 6.4, окислительно-восстановительный потенциал хлора равен + 1,36 В, а сероводорода + 0,14 В. Потенциал реакции окисления: 1,36 – 0,14 = 1,22 В, что больше нуля. Таким образом, реакция окисления возникает самопроизвольно. Хлор является окислителем, сероводород – восстановителем.
В таблице слева приведены состояния веществ в восстановленной форме (низшей степени окисления), а справа – в окисленной (высшей степени окисления). Если соотношение активностей веществ в окисленной и неокисленной формах не равно единице, то потенциал определяется по формуле В. Нернста:
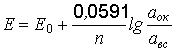 , (6.8)
, (6.8)
где Е0 – нормальный потенциал по табл. 6.4; n – число электронов, участвующих в реакции, аок, авс – активности вещества в окисленной и неокисленной (восстановительной) формах.
Таблица 6.4
Нормальные окислительно-восстановительные потенциалы,
Е0 (20 °С)
|
Окислительно-восстановительный процесс |
Е0, В |
|
Аl Û Al3++ 3e |
– 1,7 |
|
Zn Û Zn2+ + 2e |
– 0,76 |
|
Fe (OH)2 + OH– Û Fe (OH)3 + e |
– 0,56 |
|
H2S Û S + 2H+ + 2e |
+ 0,14 |
|
Fe2+ Û Fe3+ + e |
+ 0,77 |
|
2Cr3+ + 7H2O Û Cr2O72– + 14H+ + 6e |
+ 1,36 |
|
2Cl– Û Cl 2 + 2e |
+ 1,36 |
|
2H2O Û H2O2 + 2H+ + 2e |
+ 1,77 |
|
O2 + H2O Û O3 + 2H+ + 2e |
+ 2,07 |
Состояние окислительно-восстановительной редокс-системы обуславливается значениями двух независимых показателей: Е и рН. Первый из них характеризует процесс обмена электронами в ходе окисления и восстановления, а второй – участие в реакции протонов Н+ и гидроксил-ионов ОН–. Бельгийский ученый М. Пурбе предложил оценивать характер окислительно-восстановительных процессов, проходящих в редокс-системе, путем анализа диаграмм равновесия реакций в виде графиков «Е0 – рН» [7].
В редокс-системе, образованной химически чистой водой в определенных условиях, происходит восстановление молекул водорода и окисление молекул воды, согласно уравнениям: 2Н++ 2е– = Н2 и 2Н2О ↔ О2 + 4Н+ + 4е–. В результате, вода насыщается молекулярным водородом или кислородом до тех пор, пока давление этих газов не достигнет парциального (см. главу 4). Степень насыщения воды кислородом или водородом оценивается соотношением фактического и парциального давлений. Мощность редокс-системы определяется показателями rН2 и rО2, представляющими отрицательные логарифмы этих соотношений для стандартных условий (температура + 20 °С и атмосферное давление).
Если rН2 = 0, система находится в максимально возможном восстановленном, а если rН2 = 41 и rО2 = 0 – в максимально окисленном состоянии.
Между мощностью редокс-системы и показателями Е0 и рН существует связь:
![]() . (6.9)
. (6.9)
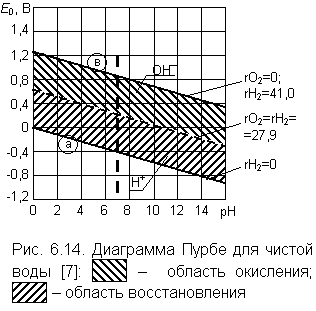 |
Область термодинамической устойчивости воды на графиках Пурбе ограничена прямыми «а», для которой rH2 = 0 и «в» – для rО2 = 0. Уравнение прямой «а» Е0 = –0,0591 рН, прямой «в» – Е0 = 1,228 – 0,0591рН. Линия, построенная для значений rH2 = rO2, делит диаграмму на две зоны: ниже расположена зона восстановления, выше – окисления (рис. 6.14). Хотя диаграмма Пурбе справедлива для химически чистой воды, ее можно использовать и для разбавленных растворов. Ход окислительно-восстановительных процессов можно контролировать по изменению мощности редокс-системы, для чего следует измерять Е и рН. Если, например, установлено, что rН2 уменьшается, то процесс окисления затухает и наоборот. Интенсивность окислительно-восстановительных процессов на границах раздела двух фаз, – воды и твердых тел, существенно возрастает. Предполагают, что причина такого роста – местное (пристенное) повышение концентрации взаимодействующих частиц, за счет чего увеличивается скорость реакции (формула 6.2). Наибольший эффект достигается в тех случаях, когда на твердых поверхностях находятся катализаторы. |