6. ХИМИЧЕСКАЯ ОЧИСТКА
- ГЛАВА 6. ХИМИЧЕСКАЯ ОЧИСТКА
- 6.1. Краткие сведения из теории
- 6.2. Нейтрализация воды и корректировка рН
- 6.2.1. Общие сведения
6. ХИМИЧЕСКАЯ ОЧИСТКА
6.1. Краткие сведения из теории
Молекулы, свободные радикалы и ионы водных примесей под влиянием диффузии и искусственного перемешивания сближаются и могут вступать в химическое взаимодействие, всегда сопровождающееся ослаблением или разрушением внутренних химических связей. Для того чтобы соответствующая химическая реакция состоялась, необходимо преодолеть некоторый энергетический барьер, который для молекул составляет 80–240 кДж/моль и более, для свободных радикалов – 60 кДж/моль, для ионов – около нуля. Следовательно, участвующие в химических реакциях частицы должны обладать достаточной энергией активации.
При необходимости, энергия активации может быть увеличена нагревом, радиационным или световым (фото) облучением, а также электроразрядами. В этих случаях электроны переводятся в возбужденное или активированное состояние.
Поскольку не все частицы оказываются активированными в достаточной степени, количество реакционно-способных частиц меньше их общего содержания. Концентрация таких частиц называется активностью
![]() = fc, (6.1)
= fc, (6.1)
где f ![]() 1,0 – коэффициент активности; с – фактическая концентрация частиц в растворе.
1,0 – коэффициент активности; с – фактическая концентрация частиц в растворе.
Для разбавленных растворов, у которых концентрация молекул растворителя, т.е. воды не лимитирует хода процесса, активность может определяться по формуле Дебая:
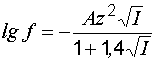 ,
,
где I – ионная сила раствора (см. ниже); z – валентность соответствующего иона; А – коэффициент, зависящий от температуры раствора. Например, при температуре +15 °С А = 0,503, при +35 °С А = 0,520.
Ионная сила раствора:
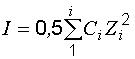 .
.
Ориентировочные значения коэффициентов активности для ионов разной валентности приведены в таблице 6.1. Из таблицы следует, что при большом солесодержании и при участии в реакциях многовалентных ионов f < 1,0, а f ~ 1,0 только для очень слабых растворов.
Таблица 6.1
Ориентировочные значения коэффициентов активности
|
Валентность, Z |
Ионная сила раствора, I |
||||||
|
0,0 |
0,001 |
0,005 |
0,01 |
0,05 |
0,1 |
0,2 |
|
|
1 |
1,0 |
0,97 |
0,93 |
0,90 |
0,81 |
0,76 |
0,70 |
|
2 |
1,0 |
0,87 |
0,74 |
0,66 |
0,44 |
0,33 |
0,24 |
|
3 |
1,0 |
0,73 |
0,51 |
0,39 |
0,15 |
0,08 |
0,04 |
|
4 |
1,0 |
0,56 |
0,30 |
0,19 |
0,04 |
0,01 |
0,003 |
При химической очистке вода обрабатывается реагентами: солями, кислотами, щелочами, металлами и другими. Реагенты, вступая в химическое взаимодействие с водными загрязнениями, обеспечивают очистку. Иногда очистка происходит путем смешивания вод разного качества, содержащих взаимно реагирующие компоненты.
Дозы реагентов определяются стехиометрическим расчетом. В связи с тем, что коэффициенты активности меньше единицы, а, также учитывая, что необходимый для реакции контакт между частицами не является абсолютно полным, расчетные дозы реагентов следует увеличивать на 5-10 % и более.
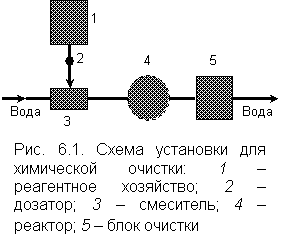 |
Принципиальная схема установки для химической очистки воды приведена на рис. 6.1. Исходная вода смешивается с реагентами в смесителе, который служит для их равномерного распределения по всему объему, и поступает в реактор. Если в результате химической реакции выделяются малорастворимые примеси (осадки, газы и т.д.) их удаляют в блоке доочистки (отстойники, фильтры, десорберы и другие). Реагентное хозяйство предназначено для хранения реагентов и для их подготовки к удобному дозированию в виде растворов или порошков. Продолжительность пребывания воды в реакторе определяется скоростью реакции, т.е. количеством вещества в единице объема, прореагировавшем за единицу времени.
В общем случае теоретическая скорость реакции определяется по зависимости:
|
где К – константа скорости реакции; a1; a2 – активность взаимодействующих частиц; n1; n2 – показатели степени, называемые порядком реакции соответствующих частиц. Для простых одностадийных процессов n равно количеству исходных частиц, одновременно взаимодействующих друг с другом в элементарном акте реакции.
Порядок реакции находится экспериментально.
Теоретическое значение константы скорости реакции определяется по формуле С. Аррениуса
![]() , (6.3)
, (6.3)
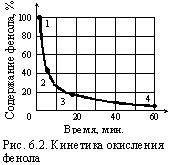 |
где A1 – коэффициент, зависящий от вероятности контакта взаимодействующих частиц, учитывающий диффузию и условия перемешивания; Ea – необходимая энергия активации частиц; R – универсальная газовая постоянная; Т – абсолютная температура. Не трудно заметить, что по мере прохождения реакции концентрация частиц убывает, и значение коэффициента A уменьшается. Поэтому термин “константа” условен и K может считаться постоянной величиной только на отдельных этапах химической реакции. Это хорошо видно из рис. 6.2, на котором приводится кинетика окисления фенола по результатам эксперимента. На участках “1 – 2” и “3 – 4” |
скорость реакции действительно прямо пропорциональна продолжительности процесса, но на участке “2 – 3” такая закономерность отсутствует.
В одномолекулярных реакциях первого порядка, например, при окислении двухвалентного железа в трехвалентное, продолжительность процесса равна:
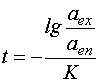 , (6.4)
, (6.4)
где aen, aex – активность частиц в начале и в конце процесса.
Для реакций второго порядка:
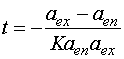 . (6.5)
. (6.5)
По известной продолжительности процесса определяется полезная вместимость реактора:
Wp = qw t, (6.6)
где qw – расчетный расход воды.
Среди основных факторов, влияющих на кинетику химических реакций, температура воды и режим перемешивания. Повышение температуры переводит электроны атомов веществ в возбужденное состояние и, как отмечалось, увеличивает активацию частиц. Согласно правилу Вант Гоффа увеличение температуры воды на 10 °С приводит к росту скорости реакции в 2–3 раза.
Искусственное перемешивание воды делает более вероятным контакт между реагирующими частицами, увеличивает значения констант скорости реакции, как это следует из формулы (1.3). Градиент скорости перемешивания ограничивается условиями, исключающими диспергирование водных примесей, в том числе образующихся при реакции.
Прохождение реакций зависит от химического состава воды. Некоторые примеси тормозят процессы, другие, вступая во взаимодействие с реагентами, конкурируют с удаляемыми загрязнениями, или интенсифицируют очистку, играя роль катализаторов. Особенно существенно присутствие в воде протонов (катионов водорода) и гидроксил – ионов, содержание которых оценивается водородным показателем рН.
Деструкция сводится к преодолению химической связи между атомами, образующими молекулы вещества водной примеси. Как известно, образование связей обусловлено строением электронных оболочек атомов. В зависимости от электронной конфигурации возникает несколько видов связей (ионная, ковалентная, донорно-акцепторная и др.). Прочность химических связей различна: от 12–15 Кдж/моль при водородной, до 500–1000 Кдж/моль (углерод-углеродная связь, ковалентные связи). Чем больше прочность химических связей, тем более усложнена химическая деструкция и тем более необходимы меры по интенсификации этого процесса.
Для оптимизации очистки химические и физические показатели качества воды следует корректировать, что учитывается при конструировании технологических схем очистки.
Нерастворимые продукты химических реакций удаляются из воды известными регенеративными методами.
Скорость химических реакций уменьшается в тех случаях, когда концентрации реагирующих частиц малы. Для достижения глубокой очистки вынужденно увеличиваются дозы реагентов сравнительно с определенными стехиометрическими расчетами. Нередко оказывается целесообразным применять химическую очистку как предварительную и доочищать воду регенеративными методами (сорбция, ионный обмен, гиперфильтрация и другие).
Нами будут рассмотрены:
- нейтрализация воды, как способ ее очистки от кислот и щелочей, а также корректировки рН, от чего зависит ход многих химических процессов очистки;- деструкция водных примесей окислительно‑восстановительными методами;- перевод водных примесей в нерастворимое состояние.6.2. Нейтрализация воды и корректировка рН
6.2.1. Общие сведения
Нейтрализацией называется реакция обмена между кислотой и основанием, при которой оба соединения теряют свои характерные свойства, и происходит образование солей.
Кислоты и основания в водном растворе диссоциируются, насыщая его катионами Н+ (кислоты) или анионами ОН– (основания). В результате водородный показатель уменьшается или увеличивается.
Причина диссоциации электролитов (кислот, щелочей и их солей) заключается в полярности молекул воды. Показателем, характеризующим способность электролитов к диссоциации в момент равновесия, когда интенсивности диссоциации и противоположного процесса ассоциации стали одинаковыми, характеризуются показателем a, отношением количества диссоциированных молекул к их первоначальному количеству. Электролиты считаются сильными, если a ![]() 0,5.
0,5.
Например, к сильным кислотам относятся: азотная, соляная (![]() более 0,9), серная (
более 0,9), серная (![]() = 0,58); к слабым – фтороводородная (
= 0,58); к слабым – фтороводородная (![]() = 0,15), уксусная (
= 0,15), уксусная (![]() = 0,13), угольная (
= 0,13), угольная (![]() = 0,017); к сильным основаниям – едкий натр (
= 0,017); к сильным основаниям – едкий натр (![]() = 0,84), гашеная известь (
= 0,84), гашеная известь (![]() = 0,90); к слабым раствор аммиака (
= 0,90); к слабым раствор аммиака (![]() = 0,013). Степень диссоциации можно определять по значению Кдис (константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lg Кдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].
= 0,013). Степень диссоциации можно определять по значению Кдис (константы диссоциации), соответствующей равновесному состоянию, и показателем pКдис = –lg Кдис. Чем более полно диссоциируется электролит, тем больше значение Кдис и меньше pКдис. Значения этих показателей приводится в литературе [1].
Соли сильных кислот и оснований хорошо диссоциируют (a ![]() 0,5) и при этом значение рН воды не меняется. Соли сильных кислот и слабых оснований или слабых кислот и сильных оснований способны гидролизоваться; при этом в первом случае выделяется катион водорода, и значение рН уменьшается, во втором – выделяется гидроксид–ион и значение рН возрастает.
0,5) и при этом значение рН воды не меняется. Соли сильных кислот и слабых оснований или слабых кислот и сильных оснований способны гидролизоваться; при этом в первом случае выделяется катион водорода, и значение рН уменьшается, во втором – выделяется гидроксид–ион и значение рН возрастает.
Для уменьшения рН воды ее обрабатывают кислотами, для повышения – основаниями. Преимущественно используют сильные электролиты.
Между концентрацией кислоты и основания и значением рН воды существуют прямые связи; соответствующие формулы приведены в табл. 6.2 [2].
Таблица 6.2
Расчет концентрации ионов Н+ и ОН-, рН растворов различных соединений
|
Раствор |
Формула для расчета |
Пример |
|
|
1. Сильная кислота разбавленная (например, НCl) |
[H+] = Ck; pH = –lgCk; |
CHCl = 0,1; [H+] = 0,1 = 10–1; pH = 1; |
|
|
2. Сильная щелочь разбавленная (например, NaOH) |
[OH–] = C0; pOH = –lgC0; pH = 14 + lgC0; |
CNaOH = 0,1; [OH–] = 10–1; pOH = 1; pH = 14 – 1 = 13; |
|
|
3. Слабая кислота (например, СН3СООН) |
[H+] = pH = 0,5(pKк – lgCк); pH = 0,5(pKк + pCк);
|
[H+]= pH = 3 – lg 1,36 = 2,87; |
|
|
4. Слабая щелочь (например, NH4OH) |
[OH–] = pOH = 0,5(pKо – lgCо); pOH = 0,5(pKо + pCо);
|
[OH–]= pOH = 4 – 0,78 = 3,22; pH = 14 – 3,22 = 10,78; |
|
|
5. Слабая кислота в присутствии ее соли (например, СН3СООН+ СН3СООNa) |
[H+] = Kк(Ск/Со); pH = pKк – lg(Со/Ск); pH = pKк +pСк – pСс;
|
[H+]=1,8×10–5 pH = 5 – lg 3,6 = 4,44; |
|
|
6. Слабая щелочь в присутствии ее соли (например, NH4OH + NH4Cl) |
[OH–] = Kо(Со/Сс); pOH = pKо – lg(Со/Сс); pOH = pKо +pСо – pСс; |
[OH–]=1,8×10–5 pOH = 5 – lg 7,2 = 4,14; pH = 14 – 4,14 = 9,86; |
|
|
7. Соль слабой кислоты и сильной щелочи (например, СН3СООNa) |
[H+] = pH=7 + 0,5(pKк + lgСc); pH=7 + 0,5(pKк – pСc); |
[H+]= = pH = 9 – lg 1,35 = 8,87; |
|
|
Раствор |
Формула для расчета |
Пример |
|
|
8. Соль слабого основания и сильной кислоты (например, NH4Cl) |
[H+] = pH=7 – 0,5(pKк + lgСc); pH=7 + 0,5(pСc – pKо); |
[H+]= pH = 6 – lg 7,4 = 5,13; |
|
|
9. Соль слабой двухосновной кислоты (например, Na2CO3) |
[H+] = pH=7+ 0,5(pK"к+ lgСc); pH=7+ 0,5(pK"к – pСc); |
[H+]= = pH = 12 – lg 2,4 = 11,62; |
|
|
10. Кислая соль слабой двухосновной кислоты (например, NaHCO3) |
[H+] = pH=0,5(pK'к+ pK"к); |
[H+]= = pH = 9 – lg 4,2 = 8,38; |
|
Принятые обозначения: Ск, Со, Сс – молярные концентрации кислоты, основания, соли; Kк, Kо – константы диссоциации кислоты, основания; K'к, K"к – первая и вторая константы диссоциации слабой двухосновной кислоты; pKк, pKо – показатели (отрицательный логарифм) константы диссоциации кислоты, основания; pСк, pСс – показатели отрицательных логарифмов концентрации кислоты, соли; pOH = 14 – pH.
Под молярной концентрацией вещества понимается количество его грамм-молекул в 1 л раствора. Связь между молярной концентрацией См и концентрацией С в г/л выражается зависимостью: С = СмМ, где М – молекулярная масса вещества.
Методика определения дозы реагента (кислоты или основания) иллюстрируется примером расчета.
Пример 6.1. Определить дозу серной кислоты, необходимую для снижения рН раствора до 4. В соответствии с примером № 9 табл. 6.2 раствор получается путем обработки воды кальцинированной содой Na2СО3 и при рН = 11,62.
Решение.
При гидролизе Na2СО3, являющейся солью слабой угольной кислоты и сильного основания (едкого натра), образуется NаОН, за счет чего и увеличивается рН воды.
Определим содержание NаОН для рН = 11,62.
рОН = 14 – рН = 14 – 11,62 = 2,38;
lgСмосн = – рОН = –2,38;
Смосн = 0,00417 моль.
Молекулярная масса едкого натра М = 40,01.
С = 0,00417 × 40,01 = 166,84×10–3 г/л = 166,84 мг/л.
Определим “x”–дозу серной кислоты, необходимого для полной нейтрализации едкого натра. Молекулярная масса Н2SО4 равна 98,0.
Н2SО4 + 2NаОН = Nа2SО4 + 2Н2О;
x = 166,84 × 98/2 × 40,01 = 204,3 мг/л.
Определим содержание серной кислоты при рН = 4.
рН = –lgСмкисл; lgСмкисл = –4;
Смкисл = 0,0001 моль; С = 0,0001 × 98 = 9,8 × 10–3 г/л = 9,8 мг/л.
Общая доза серной кислоты: 204,3 + 9,8 = 214,1 мг/л.
Если ввести к расчетной дозе серной кислоты повышающий коэффициент 1,1, как это обычно рекомендуется, то доза составит около 230 мг/л, а рН=3,48 < 4,0.
Поэтому расчетные дозы считается ориентировочными и дозирование производится в соответствии с показаниями рН-метра.
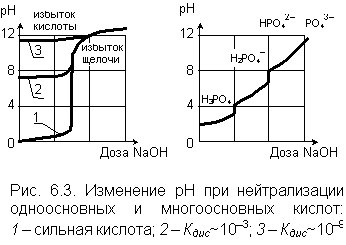 |
Изменение водородного показателя в процессе нейтрализации не пропорционально дозе вводимого нейтрализующего реагента. На рис. 6.3 приводятся графики изменения рН раствора в зависимости от дозы щелочи для одноосновных и многоосновных кислот. Напомним, что основностью кислоты называется количество содержащихся в ее молекуле ионов водорода. Для сильной одноосновной кислоты (например, соляной) рН резко возрастает в узком интервале значений доз щелочи. Этот «скачок» значений водородного показателя уменьшается, если нейтрализуются слабые кислоты, у которых константы диссоциации малы. При избытке таких кислот раствор может сохранить рН > 7.
|
График нейтрализации многоосновной кислоты (рассматривается нейтрализация трехосновной ортофосфорной кислоты) имеет ступенчатый характер со «скачками» в местах отделения катионов водорода и образования новых анионов.
Если нейтрализуемый раствор обладает буферностью, то до исчерпания буферного резерва увеличение дозы нейтрализующего реагента не вызывает изменения водородного показателя. Причина заключается в том, что вводимые для нейтрализации катионы водорода или гидроксид – ионы связываются компонентами буферных растворов в мало диссоциированные соединения.
Выбор нейтрализующих реагентов производится с учетом их эффективности (продолжительность и полнота процесса, удельные дозы реагента), количества и характера, образующихся при нейтрализации продуктов (газы, осадки, растворенные вещества), условий применения (хранение, подготовка к использованию, удобство дозирования, безопасность обслуживания реагентного хозяйства).
Наиболее часто применяют серную, реже – соляную кислоту, из щелочных реагентов – гашеную известь, кальцинированную соду, едкий натр, реже – известняк и доломит CaMg(CO3)2.
В табл. 6.3 приведены количества продуктов, образующихся при нейтрализации сильных кислот некоторыми щелочными реагентами. Как следует из таблицы, почти во всех рассмотренных случаях образуются хорошо растворимые соли. Исключением является гипс CaSO4, перенасыщенный раствор которого может вызывать образование трудноудаляемых отложений в коммуникациях и в оборудовании.
Таблица 6.3
Количество продуктов, образующихся при нейтрализации сильных кислот, в расчете грамм на грамм кислоты
|
Кислоты |
Продукты |
Основания |
||||
|
Ca(OH)2 |
CaCO3 |
NaOH |
HCO3– |
CaMg(CO3)2 |
||
|
H2SO4 |
CaSO4 |
1,39 |
1,39 |
– |
– |
0,695 |
|
Na2SO4 |
– |
– |
1,45 |
– |
– |
|
|
MgSO4 |
– |
– |
– |
– |
0,612 |
|
|
CO2 |
– |
0,45 |
– |
0,9 |
0,45 |
|
|
HCl |
CuCl2 |
1,53 |
1,53 |
– |
– |
0,775 |
|
NaCl |
– |
– |
1,63 |
– |
– |
|
|
MgCl2 |
– |
– |
– |
– |
0,662 |
|
|
CO2 |
– |
0,61 |
– |
1,22 |
0,61 |
|
|
HNO3 |
Cu(NO3)2 |
1,30 |
1,30 |
– |
– |
0,65 |
|
NaNO3 |
– |
– |
1,25 |
– |
– |
|
|
Mg(NO3)2 |
– |
– |
– |
– |
0,588 |
|
|
CO2 |
– |
0,35 |
– |
0,70 |
0,35 |
|
Реагенты вводятся в виде порошков (известь, кальцинированная сода), водных растворов (едкий натр, гашеная известь и др.), газов, активных загрузок фильтров (дробленый мрамор, известняк, доломит); Если на промышленных предприятиях образуются кислые и щелочные стоки, представляется возможной их взаимная нейтрализация путем смешения в регулируемом режиме.
Химическая реакция нейтрализации проходит мгновенно, но условия, от которых зависит ее возможность, требуют контакта между нейтрализуемым веществом и реагентом в течение 5–10 мин. и более. Наибольшая продолжительность контакта требуется в случае, если реагент вводится в виде суспензии (известковое молоко) или порошков, а также при использовании активных загрузок фильтров (мутационная фильтрация).
Корректировка рН применяется с целью оптимизации многих технологических процессов очистки воды: коагуляции, удаления из воды ионов тяжелых металлов, подготовки к сорбции или к ионному обмену, деструкции загрязнений методами окисления и восстановления. В нормах качества воды, используемой различными потребителями, как правило, указывается допустимый интервал значений рН. Так, для воды питьевого качества рН = 6,5–8,5.
Рассмотрим некоторые случаи корректировки рН воды.


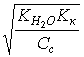 ;
;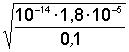 =
=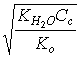 ;
;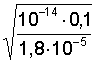 =7,4
=7,4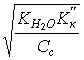 ;
;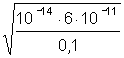 =
=

